
【题目】A、B、C、D、E 五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中 A 为澄清溶液,C 为难溶的白色固体,E 则易溶于水,若取 A 溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃)。

请回答下列问题:
(1)写出化学式:A_____,B_____,C_____,D_____,E_____。
(2)写出下列反应的离子方程式: A→B:____ B→D:_____C→E:_____
【答案】KAlO2 Al(OH)3 A12O3 AlCl3 NaAlO2 AlO2-+CO2+2H2O= Al(OH)3↓+HCO3- Al(OH)3+3H+=Al3++3H2O A12O3+2OH-=2AlO2-+H2O
【解析】
B、C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片),说明A中含有K元素,A能与二氧化碳反应生成Al(OH)3,则A应为KAlO2,结合对应物质的性质解答该题。
(1)通过以上分析知,A、B、C、D、E分别是KAlO2、Al(OH)3、A12O3、AlCl3、NaAlO2,
故答案为:KAlO2;Al(OH)3;A12O3;AlCl3;NaAlO2;
(2)A→B的反应为AlO2-和Al(OH)3的转化,反应的离子方程式为AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-,
B→D的反应为Al(OH)3和Al3+的转化,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-;Al(OH)3+3H+=Al3++3H2O;
(3)C→E的反应为氧化铝溶于氢氧化钠溶液,反应的离子方程式:A12O3+2OH-=2AlO2-+H2O,
故答案为:A12O3+2OH-=2AlO2-+H2O。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
![]()
![]()
![]() +H2O
+H2O

可能用到的有关数据如下:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是__________.
(2)加入碎瓷片的作用是_________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________________.
(4)分液漏斗在使用前须清洗干净并__________;在本实验分离过程中,产物应该从分液漏斗的______________(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是_______________.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有______(填正确答案标号).
A.蒸馏烧瓶 B.温度计 C.吸滤瓶 D.冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号).
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取物质、探究物质的性质是学习化学必备的素养之一。
回答下列问题。
(1)实验室从含碘废液(除水外含CCl4、I2、I-等)中回收碘,其实验流程如下。

回答下列问题:
①物质X的名称为________;
②操作Ⅰ选用的装置为______(填标号);

③含碘废液中加入稍过量的Na2SO3溶液将I2还原为I-,反应的离子方程式为___。
④氧化剂Y可用Cl2,也可以用H2O2。将同物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为________。
(2)某研究小组查阅资料知:氧化性的强弱顺序为:Cl2>IO3->I2。用如图装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。

①NaOH溶液的作用是______,反应的离子方程式为___________。
②溶液由黄色最后变为无色所发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:

Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
(1)棉花中浸润的溶液为____________,目的是________________。
(2)实验室制备氯气的化学方程式为______________________。
(3)过程Ⅲ中一定发生反应的离子方程式为______________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是_____________________。
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是_______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。

(1)A中装有Ca(OH)2和NH4Cl混合粉末,该反应的化学方程式是________________。
(2)B中加入的是碱石灰,其作用是_______________________________。
(3)实验时在C中观察到的现象是________________________________。发生反应的化学方程式是:______________________________。
(4)D中收集到的物质是____________,检验该物质的方法和现象是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是

A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10﹣10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | ﹣ | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | ﹣2 | ﹣ | ﹣2 | ﹣ | ﹣4 | ﹣3 | ﹣1 | ﹣ | ﹣3 | ﹣4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号).比元素B原子序数大7的元素在元素周期表中的位置:第____________,其基态原子的核外电子排布式是___________.
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)______.
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成σ键与π键之比_________;I与氢元素形成的10电子分子X的空间构型为_____。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是__________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2结构相似,该晶体储氢后的化学式应为___________ 。
(5)如图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:_______________
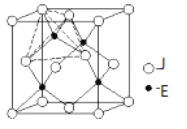
(6)如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为___,若晶胞边长为a pm,则晶体的密度为(用含a、NA的代数式表示)________________(g/mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下四种物质:A. ![]() ,B.Ca(ClO)2 ,C.NO2,D.Si,请根据题意,选择恰当的选项用字母代号填空。
,B.Ca(ClO)2 ,C.NO2,D.Si,请根据题意,选择恰当的选项用字母代号填空。
(1)漂白粉的有效成分是________;
(2)通常状况下带有特殊气味、不溶于水的液体是_______;
(3)通常状况下呈红棕色的是________;
(4)电子工业中作为半导体材料的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com