
【题目】工业上以铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
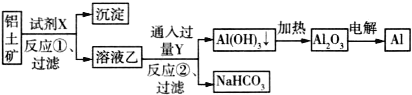
下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
D.图中所有反应都不是氧化还原反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】由下列实验及现象推出相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 某溶液中加入Ba(NO3)2溶液,再加足量盐酸 | 先有白色沉淀生成,加盐酸后白色沉淀不消失 | 原溶液中有SO42- |
B | 将湿润的淀粉碘化钾试纸放在盛有红棕色气体的集气瓶口 | 试纸变蓝 | 红棕色气体为溴蒸气 |
C | 将碳酸钠与盐酸反应产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
D | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成,后转变为蓝色沉淀 | 溶解度:Cu(OH)2<Mg(OH)2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩十种元素在周期表中的位置:
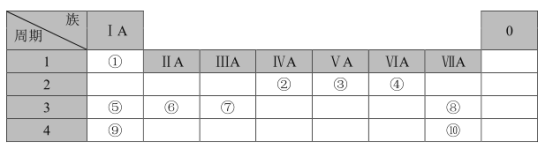
请按要求回答下列问题:
(1)元素⑤的原子结构示意图为___;元素②的最高价氧化物的电子式是___。
(2)⑤、⑥、⑨三种元素原子半径由大到小的顺序是___(填元素符号);这三种元素最高价氧化物对应水化物中碱性最强的是___(填化学式)。
(3)③、④元素的简单氢化物的稳定性较弱的是___(填化学式)。
(4)①、②、④三种元素形成的有机物的分子结构模型如图所示,写出该有机物的结构简式:___;①与②所形成的最简单的烯烃与溴的四氯化碳溶液反应的化学方程式:___。

(5)元素⑦的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式:___。
(6)写出元素⑨的单质与水反应的化学方程式:___。
(7)请从原子结构的角度解释,元素⑧非金属性比元素⑩强的原因:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:
(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示:
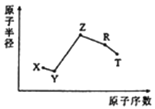
己知:TX2是现代光学及光纤制品的基本原料:ZY能破坏水的电离平衡:Z3RY6在工业上常用作助熔剂。下列说法不正确的是
A.R在元素周期表中的位置是第三周期第ⅢA族
B.上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的电子式为![]() 或
或![]()
C.工业上以Z3RY6作助熔剂的目的是降低氧化铝沸点,节约冶炼铝的原料
D.己知11.5 g Z的单质在X2中完全燃烧,恢复至室温,放出Q kJ热量,该反应的热化学方程式为2Na(s)+O2(g)=Na2O2(s) △H=-4Q kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素,如图是实验室从海藻中提取捵的部分流程:
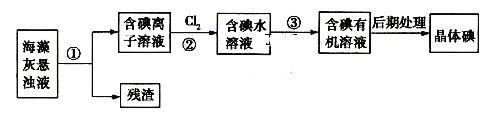
下列判断不正确的是
A.步骤①、③的操作分别是过滤、萃取分液
B.步骤②中反应的离子方程式为:![]()
C.可用淀粉溶液检验步骤②中的反应是否进行完全
D.步骤③中加入的有机溶剂可以是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如图:
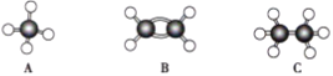
(1).等质量的以上物质完全燃烧时耗去O2的量最多的是______(填对应字母,下同)
(2).同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是______
(3).等质量的以上三种物质燃烧时,生成水最多的是______
(4).在120℃、1.01×105Pa条件下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着化工产业的迅猛发展,氯化氢转化为氯气的技术成为科学研究的热点。请按要求回答下列问题:
(1)HCl直接氧化法制Cl2可按下列催化过程进行:
CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1 = +83 kJ·mol-1
CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2 = -20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3 = -121 kJ·mol-1
写出HCl直接氧化法制Cl2的热化学方程式:____________________________。
(2)在恒定容器中用上述HCl直接氧化法制Cl2,进料c(HCl) ∶c(O2)分别为1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如下图所示:
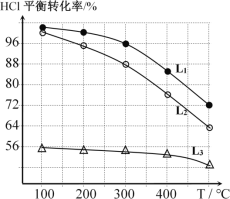
①判断图中c(HCl) /c(O2) = 1:1的曲线为________。
②按化学计量系数比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料时c(HCl)/c(O2)过低、过高的不利影响分别是____________、________。
③综合上述信息,写出在一定温度的条件下进一步提高HCl的转化率的方法: ________________________________________。
④观察上图,以任何一条曲线为例,平衡常数K(200℃)________K(300℃)(填“大于”、“小于”或“等于”)。
⑤设O2初始浓度为c,计算L2对应K(300℃) =____________(列出含c的计算式)。
(3)科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
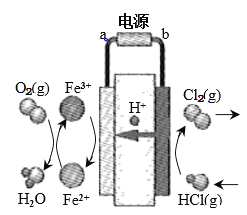
①电源b极为____________极。
②写出阳极区域反应方程式:________________________________________。
③电路中转移1 mol电子时,阳极产生气体体积为__________________L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com