
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应.根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
A.v(H2)=0.1 molL﹣1min﹣1
B.v(N2)=0.2 molL﹣1min﹣1
C.v(NH3)=0.15 molL﹣1min﹣1
D.v(H2)=0.3 molL﹣1min﹣1
【答案】B
【解析】解:都转化为氢气表示的速率进行比较,对于N2+3H22NH3 ,
A、v(H2)=0.1 molL﹣1min﹣1 ,
B、v(N2)=0.2 molL﹣1min﹣1 , 速率之比等于化学计量数之比,故v(H2)=3v(N2)=0.6molL﹣1min﹣1
C、v(NH3)=0.15 molL﹣1min﹣1 , 速率之比等于化学计量数之比,故v(H2)= ![]() v(N2)=
v(N2)= ![]() ×0.15molL﹣1min﹣1=0.225molL﹣1min﹣1 ,
×0.15molL﹣1min﹣1=0.225molL﹣1min﹣1 ,
D、v(H2)=0.3molL﹣1min﹣1 ,
故速率B>D>C>A,
故选B.
【考点精析】掌握反应速率的定量表示方法是解答本题的根本,需要知道反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】下列对分子及其性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.乳酸[CH3CH(OH)COOH]中存在一个手性碳原子
C.许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物
D.已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测得某溶液中仅含Na+、Mg2+、SO42—、Cl— 四种离子,其中离子个数比为:N(Na+)︰N(Mg2+)︰N(Cl—) = 4︰5︰8,若设N(Na+)为4a个,则SO42—离子个数为( )
A. 2a B. 3a C. 6a D. 8a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是表示铁原子和铁离子的3种不同化学用语。
结构示意图 | 电子排布式 | 电子排布图 | |
铁 原 子 |
| 1s22s22p63s23p63d64s2 |
|
铁 离 子 |
| 1s22s22p63s23p63d5 |
|
(1)铁原子最外层电子数为 ,铁在发生化学反应时,参加反应的电子可能是 。
(2)请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( ) 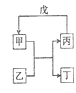
选项 | 甲 | 乙 | 丙 | 戊 |
A | NH3 | O2 | NO | H2O |
B | Fe | H2O | H2 | Fe2O3 |
C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
D | Na2O2 | CO2 | O2 | Na |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验表明;纯硫酸液体的电离能力强于纯硝酸;纯硫酸的导电性强于纯水;又知液态电解质都能像水一样自身电离;而建立电离平衡(即像2H2O![]() H3O++OH-);且在一定温度下都有各自的离子积常数。
H3O++OH-);且在一定温度下都有各自的离子积常数。
据此回答下列问题:
(1)纯硫酸在液态时;自身电离的电离反应方程式是 ;它在25 ℃时的离子积常数K(H2SO4)比水的离子积常数K(H2O) (填“大”“小”或“相等”)。
(2)在纯硫酸与纯硝酸的液态混合物中;存在的阴离子主要是 ;这是因为混合液中不但存在两种电离平衡(即H2SO4和HNO3各自的电离平衡;且硫酸的酸性强于硝酸);又在无水的条件下;混合酸中发生 (写离子反应方程式)反应而造成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1 452kJmol﹣1
H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJmol﹣1
下列说法正确的是( )
A.H2(g)的燃烧热为571.6 kJmol﹣1
B.0.5H2SO4(aq)+0.5Ba(OH)2(aq)═0.5BaSO4(s)+H2O(l)△H=﹣57.3 kJmol﹣1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的Al(OH)3。他们分别设计了两种实验方案:
方案一:![]()
方案二:![]()
(1)从节约药品的角度思考,你认为哪一种方案好?_____________,方案一和方案二共同存在的问题是___________________
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com