
【题目】Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的Al(OH)3。他们分别设计了两种实验方案:
方案一:![]()
方案二:![]()
(1)从节约药品的角度思考,你认为哪一种方案好?_____________,方案一和方案二共同存在的问题是___________________
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式。
【答案】(1)方案二较好 方案一在加入NaOH溶液和方案二在加入H2SO4溶液时,均难以控制加入的量以确保Al元素全部沉淀。
(2)将Al按1∶3分成两份,第一份与硫酸溶液反应,第二份与NaOH溶液反应,然后将所得溶液混合即可。有关反应的化学方程式为:
2Al+3H2SO4===Al2(SO4)3+3H2↑
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Al2(SO4)3+6NaAlO2+12H2O===8Al(OH)3↓+3Na2SO4
【解析】(1)设同样制备1 mol Al(OH)3,根据设计的方案中涉及的反应计算,方案一需1 mol Al、1.5 mol H2SO4、3 mol NaOH,方案二需1 mol Al、0.5 mol H2SO4、1 mol NaOH,故方案二比方案一节约药品。但方案一加入NaOH溶液和方案二中加入H2SO4溶液时,均难以控制加入的量以确定Al元素全部进入沉淀。
(2)按下图,将1 mol Al分成两部分去做,将所得溶液合并:
1 mol Al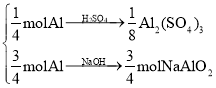
1 mol Al(OH)3。
实验中只需1 mol Al、0.375 mol H2SO4、0.75 mol NaOH,且无需担心Al元素不能全部进入沉淀。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应.根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
A.v(H2)=0.1 molL﹣1min﹣1
B.v(N2)=0.2 molL﹣1min﹣1
C.v(NH3)=0.15 molL﹣1min﹣1
D.v(H2)=0.3 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K37CIO3晶体与H35Cl溶液反应生成氯化钾、氯气和水,实验测得此反应生成的氯气的分子量是( )
A.73.3B.73C.72D.70.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某非金属单质 A 和氧气发生化合反应生成B,B为气体,其体积是反应掉氧气体积的两倍(同温同压)。关于B 分子组成的推测一定正确的是( )
A. 有 2个氧原子 B. 有1个氧原子 C. 有1个A原子 D. 有2个A原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
请回答下列问题:
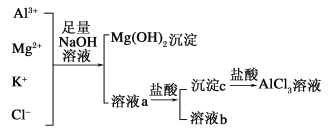
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:____________。
(2)氢氧化钠溶液能否用氨水代替,为什么?_________________。
(3)溶液a中存在的离子有________;在溶液a中加入盐酸时需控制盐酸的量,其原因为_________________。为此,改进方法是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别下列有关物质的描述不正确的是( )
A.用氢氧化钠溶液区别乙醇溶液和葡萄糖溶液
B.用碳酸钠溶液区别乙酸和乙酸乙酯
C.用金属钠区别无水乙醇和乙酸乙酯
D.用溴水区别甲烷和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明褐色沉淀具有 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2 , 过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能含有阴离子:NO ![]() 、SO42﹣、SO32﹣、CO32﹣、AlO
、SO42﹣、SO32﹣、CO32﹣、AlO ![]() ,阳离子:K+、Al3+、Cu2+、NH
,阳离子:K+、Al3+、Cu2+、NH ![]() 、Na+ . 为了鉴定其中的离子,现进行如下实验,实验现象和结论相符的是( )
、Na+ . 为了鉴定其中的离子,现进行如下实验,实验现象和结论相符的是( )
A.向溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明一定含有SO ![]()
B.向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有气体逸出,说明一定存在CO32﹣和AlO ![]()
C.用焰色反应检验时,透过蓝色钴玻璃观察火焰呈紫色,则说明含有K+没有Na+
D.取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,说明不存在NH ![]() 、Al3+、Cu2+
、Al3+、Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com