
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
请回答下列问题:
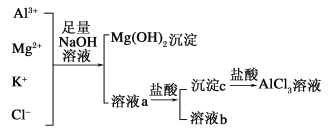
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:____________。
(2)氢氧化钠溶液能否用氨水代替,为什么?_________________。
(3)溶液a中存在的离子有________;在溶液a中加入盐酸时需控制盐酸的量,其原因为_________________。为此,改进方法是_____________________。
【答案】(1)Mg2++2OH-===Mg(OH)2↓ Al3++3OH-===Al(OH)3↓ Al(OH)3+OH-===AlO2-+2H2O
(2)不能,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开
(3)Cl-、K+、AlO2-、OH-、Na+ 因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2-时,需要控制盐酸的量,以防止部分AlO2-转化成Al3+ 通入过量二氧化碳气体
【解析】(1)加入足量氢氧化钠溶液,Mg2+可与OH-反应生成Mg(OH)2沉淀,Al3+先与OH-反应生成Al(OH)3,生成的Al(OH)3继续与OH-反应生成NaAlO2和H2O。(2)氢氧化钠溶液不能用氨水代替,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开。
(3)加入氢氧化钠溶液后除去了Mg2+,但又引入了Na+,同时Al3+转化成了AlO2-;因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2-时,需要控制溶液的pH,以防止部分AlO2-转化成Al3+;氢氧化铝只能与强碱或强酸反应,因此,可在溶液a中通入过量二氧化碳气体。


科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( ) 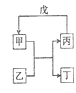
选项 | 甲 | 乙 | 丙 | 戊 |
A | NH3 | O2 | NO | H2O |
B | Fe | H2O | H2 | Fe2O3 |
C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
D | Na2O2 | CO2 | O2 | Na |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是 ( )
A. 蒸馏操作时,应使冷凝水上口进下口出
B. 蒸馏操作时,应使温度计水银球位于蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,再将上层液体从下口放到另一个烧杯中
D. 萃取操作时,选择萃取剂时,萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是某学校实验室从市场买回的试剂标签上的部分内容,据此下列说法正确的是( ) 

A.该硫酸和氨水的物质的量浓度分别约为18.4molL﹣1和6.3molL﹣1
B.各取5mL与等质量的水混合后,c(H2SO4)<9.2molL﹣1 , c(NH3)>6.45molL﹣1
C.各取5mL与等体积的水混合后,ω(H2SO4)<49%,ω(NH3)>12.5%
D.各取10mL于两烧杯中,再分别加入一定量的水即可得到较稀的硫酸溶液和氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某非金属元素R的氢化物及其氧化物、盐之间具有如下转化关系(部分产物省略):氢化物 ![]() B
B ![]() C,下列判断中正确的是( )
C,下列判断中正确的是( )
A.若R是硫元素、则C是Na2SO3
B.若R是硅元素、则C是Na2Si03
C.若R是碳元素、则C是Na2CO3
D.若R是氯元素、则C是NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的Al(OH)3。他们分别设计了两种实验方案:
方案一:![]()
方案二:![]()
(1)从节约药品的角度思考,你认为哪一种方案好?_____________,方案一和方案二共同存在的问题是___________________
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
(1)六种元素中第一电离能最小的是;(填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂);请写出黄血盐的化学式 , 1mol AB﹣中含有π键的数目为(阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及(填序号);
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2═CH2、②HC≡CH、③ ![]() 、④HCHO.其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为 , 它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是 .
、④HCHO.其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为 , 它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水处理金属钠与碳化钙的混合物,有气体放出,此气体在催化剂作用下恰好完全反应,生成另一种气体A.气体A完全燃烧时,需要3.5倍体积的氧气,则金属钠与碳化钙的物质的量之比是( )
A.2:1
B.1:2
C.4:1
D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明褐色沉淀具有 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2 , 过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com