
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明褐色沉淀具有 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2 , 过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为
【答案】
(1)SO2
(2)黑色沉淀中不含有CuO
(3)还原;NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+
(4)CuS存在溶解平衡CuS(s)?Cu2+(aq)+S2﹣(aq),热的浓硫酸将S2﹣氧化,使S2﹣浓度减小,促进上述平衡向正向移动,使CuS溶解
(5)40%
【解析】解:(1.)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓) ![]() CuSO4+2SO2↑+2H2O,步骤Ⅱ产生的气体是SO2 , 故答案为:SO2;
CuSO4+2SO2↑+2H2O,步骤Ⅱ产生的气体是SO2 , 故答案为:SO2;
(2.)向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+ , 根据②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀可知,黑色固体中一定不含CuO,故答案为:黑色沉淀中不含有CuO;
(3.)a、A试管内上方出现红棕色气体,说明反应中有一氧化氮生成,证明了黑色固体具有还原性,在反应中被氧化,
故答案为:还原;b、根据反应现象③B试管中出现白色沉淀可知,白色沉淀为硫酸钡,说明黑色固体中含有硫元素;发生反应的离子方程式为:NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ , 故答案为:NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+;
(4.)CuS难溶于水,在水溶液中会有很少量的Cu溶解,溶液中存在沉淀溶解平衡,CuS(s)Cu2+(aq)+S2﹣(aq),热的浓硫酸将S2﹣氧化,使S2﹣浓度减小,促进上述平衡向正向移动,使CuS溶解;故答案为:CuS存在溶解平衡CuS(s)Cu2+(aq)+S2﹣(aq),热的浓硫酸将S2﹣氧化,使S2﹣浓度减小,促进上述平衡向正向移动,使CuS溶解;
(5.)发生的反应为:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
MnO4﹣+5Fe2++8H+═Mn2++5Fe3++4H2O
设Cu2S、CuS的物质的量分别为x、y,
与Cu2S、CuS反应后剩余KMnO4的物质的量:0.035L×0.1mol/L× ![]() =0.0007mol,
=0.0007mol,
160x+96y=0.2![]() +
+ ![]() =0.04×0.075﹣0.0007
=0.04×0.075﹣0.0007
解得x=0.0005mol,
Cu2S的质量分数: ![]() ×100%=40%,故答案为:40%.
×100%=40%,故答案为:40%.
(1)根据铜与浓硫酸反应生成二氧化硫气体进行解答;(2)根据题中信息中检验铜离子的方法对②进行分析,然后得出正确结论;(3)a、红棕色气体为二氧化氮,说明稀硝酸被还原生成一氧化氮,黑色固体具有还原性;b、根据反应现象③可知黑色固体与稀硝酸反应生成了二氧化硫,证明黑色固体中含有硫元素;二氧化氮、二氧化硫的混合气体能够与氯化钡反应生成硫酸钡沉淀,据此写出反应的离子方程式;(4)CuS在溶液中存在沉淀溶解平衡,根据平衡移动分析;(5)依据滴定实验数据计算剩余高锰酸钾物质的量,得到和硫化亚铜、硫化铜反应的高锰酸钾物质的量,依据反应的离子方程式列式计算得到.


科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
请回答下列问题:
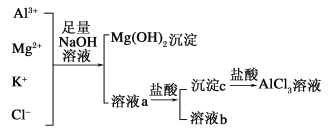
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:____________。
(2)氢氧化钠溶液能否用氨水代替,为什么?_________________。
(3)溶液a中存在的离子有________;在溶液a中加入盐酸时需控制盐酸的量,其原因为_________________。为此,改进方法是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明末清初著名的科学家宋应星在其《天工开物》中介绍:凡石灰经火焚炼为用。……百里内外,土中必生可燔石,石以青色为上,黄白次之。石必掩土内二三尺,掘取受燔,土面见风者不用。其中的“可燔石”指( )
A.氧化钙B.碳酸钠C.碳酸钙D.氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃
B.分子组成符合CnH2n+2的烃一定是烷烃
C.正戊烷分子中所有原子均在一条直线上
D.碳氢原子个数比为1:3的烃有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在最适温度下,反应物浓度对酶促反应的影响,据图分析下列选项中错误的一组是 ( )

①在A点时,随着反应物浓度的增加,反应速率加快
②在B点时,反应物浓度限制了酶促反应速率的提高
③如果在C点时加入少量的酶,会使反应速率加快
④如果在A点时温度升高10℃,曲线上升的幅度会变大
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1乙氧基萘是一种无色液体,密度比水的大,不溶于水,易溶于乙醇,熔点为5.5℃,沸点为267℃。1萘酚(性质与苯酚相似)的熔点为96℃,沸点为278℃,微溶于水,易溶于乙醇。乙醇的沸点为78.5℃。1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的反应原理如下:

(1)将72g1萘酚溶于100mL无水乙醇中,再加入5mL浓硫酸。将混合溶液置于如图所示的圆底烧瓶中加热充分反应。实验中使用过量乙醇的原因是________。烧瓶上连接长玻璃管的主要作用是________________。

(2)反应结束后将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是________(填序号)。
A.③②④① B.①②③④ C.②①③④
(3)实验测得1乙氧基萘的产量与反应时间、温度的关系如图所示,时间延长、温度升高,1乙氧基萘的产量下降的原因可能是__________、____________。

(4)某同学推测经提纯的产品可能还含有1萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请完成表中内容。
实验目的 | 实验操作 | 预期现象和结论 |
①用金属钠检验1乙氧基萘是否纯净 | 取少量经提纯的产品于试管A中,加入金属钠 | 若________,则产品纯净; 若________,则产品不纯 |
②检验经提纯的产品是否含有1萘酚 | ____________ ____________ | 若____________,则含有1萘酚; 若____________,则不含1萘酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2AB(g)+2C(g),且达到平衡.当升高温度时气体的密度增大,则下列叙述中正确的是( )
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.若向容器中充入惰性气体,则平衡向右移动
D.物质A一定为非气态,且正反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com