
【题目】某非金属元素R的氢化物及其氧化物、盐之间具有如下转化关系(部分产物省略):氢化物 ![]() B
B ![]() C,下列判断中正确的是( )
C,下列判断中正确的是( )
A.若R是硫元素、则C是Na2SO3
B.若R是硅元素、则C是Na2Si03
C.若R是碳元素、则C是Na2CO3
D.若R是氯元素、则C是NaCl
【答案】C
【解析】解:A.若R是S元素,B能和过氧化钠反应,则B是SO2 , 二氧化硫具有还原性,过氧化钠具有强氧化性,所以SO2和Na2O2发生氧化还原反应,反应方程式为Na2O2+SO2=Na2SO4 , 所以C是Na2SO4 , 故A错误;
B.若R是Si元素,B能和Na2O2反应,则B为H2O,水和过氧化钠反应方程式为2H2O+2Na2O2=4NaOH+O2↑,C应该是NaOH,故B错误;
C.若R是C元素,B能和Na2O2反应,则B为CO2 , 过氧化钠和二氧化碳反应方程式为2CO2+2Na2O2=2Na2CO3+O2 , C为Na2CO3 , 故C正确;
D.若R是Cl元素,HCl和氧气不反应,所以得不到B,故D错误;
故选C.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】向某Na2CO3溶液中逐滴滴加1 mol·L-1的盐酸,测得溶液中Cl-、HCO的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法中正确的是( )

A.Oa段反应的离子方程式与ab段反应的离子方程式相同
B.该Na2CO3溶液中含有1 mol Na2CO3
C.b点的数值为0.6
D.b点时生成CO2的物质的量为0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列热化学方程式
① C(s)+O2(g)═CO2 (g)△H1=﹣393.5kJ/mol
② H2(g)+ ![]() O2(g)═H2O(l)△H2=﹣285.8kJ/mol
O2(g)═H2O(l)△H2=﹣285.8kJ/mol
③ CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
A.△H=﹣488.3 kJ/mol
B.△H=+244.1 kJ/mol
C.△H=﹣996.6 kJ/mol
D.△H=+996.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
请回答下列问题:
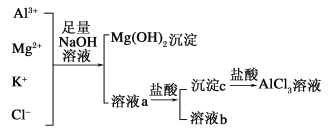
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:____________。
(2)氢氧化钠溶液能否用氨水代替,为什么?_________________。
(3)溶液a中存在的离子有________;在溶液a中加入盐酸时需控制盐酸的量,其原因为_________________。为此,改进方法是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素形成的纯净物A、B、C、D、E,五种物质之间的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同).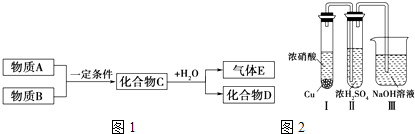
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式 , 并任写一种C的主要用途 .
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物.
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可): .
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系: .
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 .
②已知常温下物质A与物质B反应生成1mol气体C的△H=﹣57kJmol﹣1 , 1mol气体C与H2O反应生成化合物D和气体E的△H=﹣46kJmol﹣1 , 写出物质A与物质B及水反应生成化合物D的热化学方程式为 .
③有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2所示装置进行实验.
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是 .
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在最适温度下,反应物浓度对酶促反应的影响,据图分析下列选项中错误的一组是 ( )

①在A点时,随着反应物浓度的增加,反应速率加快
②在B点时,反应物浓度限制了酶促反应速率的提高
③如果在C点时加入少量的酶,会使反应速率加快
④如果在A点时温度升高10℃,曲线上升的幅度会变大
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com