
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
(1)六种元素中第一电离能最小的是;(填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂);请写出黄血盐的化学式 , 1mol AB﹣中含有π键的数目为(阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及(填序号);
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2═CH2、②HC≡CH、③ ![]() 、④HCHO.其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为 , 它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是 .
、④HCHO.其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为 , 它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是 .
【答案】
(1)K
(2)K4[Fe(CN)6];2NA;def
(3)①③④;平面三角;加成产物CH3OH分子之间能形成氢键
【解析】解:前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2 , 3d84s2 , 故D为Fe、E为Ni,
(1.)六种元素中K的金属性最强,其第一电离能最小,非金属性越强电负性越大,故电负性最大的是N,
所以答案是:K
(2.)黄血盐的化学式K4[Fe(CN)6],CN﹣与氮气互为等电子体,CN﹣中存在C≡N三键,故1mol CN﹣中含有π键的数目为2NA , 黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,
所以答案是:K4[Fe(CN)6];2NA;def;
(3.)①CH2=CH2、③  、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为 平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,
、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为 平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,
所以答案是:①③④;平面三角;加成产物CH3OH分子之间能形成氢键.


科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学,正确的实验操作是完成实验任务的保证。下列做法中,不合理的是( )
A. 在实验室里制取气体时,先检查装置的气密性
B. 做铁丝在氧气中燃烧实验时,预先在集气瓶中加少量水
C. 稀释浓硫酸时,将浓硫酸注入盛水的量筒中
D. 做氢气燃烧实验时,先检查氢气的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
请回答下列问题:
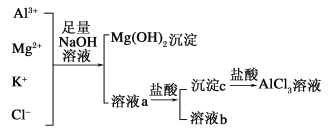
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:____________。
(2)氢氧化钠溶液能否用氨水代替,为什么?_________________。
(3)溶液a中存在的离子有________;在溶液a中加入盐酸时需控制盐酸的量,其原因为_________________。为此,改进方法是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素形成的纯净物A、B、C、D、E,五种物质之间的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同).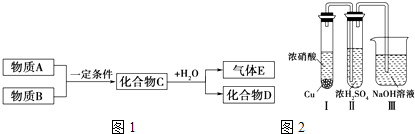
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式 , 并任写一种C的主要用途 .
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物.
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可): .
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系: .
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 .
②已知常温下物质A与物质B反应生成1mol气体C的△H=﹣57kJmol﹣1 , 1mol气体C与H2O反应生成化合物D和气体E的△H=﹣46kJmol﹣1 , 写出物质A与物质B及水反应生成化合物D的热化学方程式为 .
③有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2所示装置进行实验.
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是 .
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明褐色沉淀具有 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2 , 过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明末清初著名的科学家宋应星在其《天工开物》中介绍:凡石灰经火焚炼为用。……百里内外,土中必生可燔石,石以青色为上,黄白次之。石必掩土内二三尺,掘取受燔,土面见风者不用。其中的“可燔石”指( )
A.氧化钙B.碳酸钠C.碳酸钙D.氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com