
【题目】目前,世界上生产的镁有60%来自海水,其生产流程图如下:
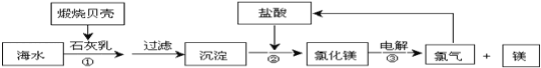
(1)贝壳的主要化学成分为_________(写化学式)。
(2)写出反应②的离子方程式:_____________。
(3)根据流程图可知,可循环利用的物质是__________。
(4)Mg与CO2反应时,有白色粉末并有黑色固体生成。请写出Mg与CO2反应的化学方程式,并用双线桥标出电子转移的方向与数目________。氧化剂是___________,氧化产物是_________。
(5)Na比Mg和Al要活泼,将Na投入到Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为_________。
【答案】CaCO3 Mg(OH)2+2H+=Mg2++2H2O Cl2或HCl 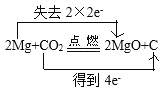 CO2 MgO 6Na+6H2O+2Fe3+=6Na++2Fe(OH)3↓+3H2↑
CO2 MgO 6Na+6H2O+2Fe3+=6Na++2Fe(OH)3↓+3H2↑
【解析】
海水晒盐得到的卤水中加入煅烧贝壳得到的氧化钙,CaO溶于水生成的氢氧化钙石灰乳,用来沉淀Mg2+,形成Mg(OH)2沉淀,过滤后向得到氢氧化镁加入盐酸溶解富集镁元素得到氯化镁,然后蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢气流中脱水得到固体氯化镁,电解熔融氯化镁得到镁和氯气;镁在点燃时与CO2反应产生氧化镁和碳单质;将Na投入到Fe2(SO4)3溶液中,首先是钠与水反应产生氢氧化钠和氢气,氢氧化钠与硫酸铁发生复分解反应产生氢氧化铁沉淀。
(1)贝壳的主要成分是碳酸钙,化学式为CaCO3;
(2)反应②是氢氧化镁溶解于盐酸中反应生成氯化镁和水,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;
(3)由流程可知,电解熔融氯化镁制得氯气,氯气和氢气点燃生成氯化氢,可循环使用;
(4)Mg与CO2反应时,有白色粉末氧化镁并有黑色固体碳生成,Mg与CO2反应的化学方程式为:2Mg+CO2![]() 2MgO+C,在该反应中镁失电子,碳得到电子生成碳单质,用双线桥表示的氧化还原反应为:
2MgO+C,在该反应中镁失电子,碳得到电子生成碳单质,用双线桥表示的氧化还原反应为: ;反应中C化合价从+4价变化为0价,化合价降低,获得电子,C作氧化剂;Mg的化合价由0价变为+2价,化合价升高,失去电子。Mg作还原剂,MgO是氧化产物;
;反应中C化合价从+4价变化为0价,化合价降低,获得电子,C作氧化剂;Mg的化合价由0价变为+2价,化合价升高,失去电子。Mg作还原剂,MgO是氧化产物;
(5)将Na投入到Fe2(SO4)3溶液中,首先是钠与水反应产生氢氧化钠和氢气,然后是产生氢氧化钠与硫酸铁发生复分解反应产生氢氧化铁沉淀和硫酸钠,反应的离子方程式为:6Na+6H2O+2Fe3+=6Na++2Fe(OH)3↓+3H2↑。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】已知pAg+=lgc(Ag+),pX=lgc(X)。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
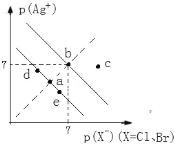
A. a和c两点的Kw相同
B. Ksp(AgCl)=1.0×1014 mol2·L2
C. 向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
D. AgCl(s)+Br(aq)![]() AgBr (s)+Cl(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
AgBr (s)+Cl(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )
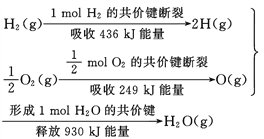
A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由C(石墨)=C(金刚石)ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
C. 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)![]() 2H2O(l) ΔH=+285.8 kJ·mol-1
2H2O(l) ΔH=+285.8 kJ·mol-1
D. 在稀溶液中:H++OH-![]() H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=______。
(4)原气体中a∶b=________。
(5)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)![]() C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A. 再充入2mol A,平衡正移,A的转化率增大
B. 如果升高温度,C的体积分数增大
C. 如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D. 再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。在1LHA和HB的溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )
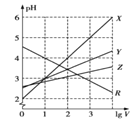
A.X是HA,Y是HB
B.常温下pH:NaA溶液>NaB溶液
C.若常温下,浓度均为0.1mol/L的NaA和HA的混合溶液pH>7,则c(A-)>c(HA)
D.在等浓度的NaA和NaB混合溶液中通入HCl至中性时,c(Cl-)=c(HA)+c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4LCCl4中含原子总数为5NA
B.物质的量浓度为0.5![]() MgCl2溶液中,含有Cl—数目为NA
MgCl2溶液中,含有Cl—数目为NA
C.常温常压下,NA个CO2分子占的体积大于22.4L
D.3.2g由氧气和臭氧组成的混合物中含有氧气分子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
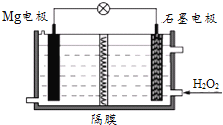
A.Mg电极是该电池的正极
B.溶液中的Cl-向正极移动
C.H2O2在石墨电极上发生氧化反应
D.石墨电极附近溶液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com