
【题目】已知pAg+=lgc(Ag+),pX=lgc(X)。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
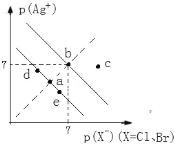
A. a和c两点的Kw相同
B. Ksp(AgCl)=1.0×1014 mol2·L2
C. 向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
D. AgCl(s)+Br(aq)![]() AgBr (s)+Cl(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
AgBr (s)+Cl(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
【答案】B
【解析】
由图可知,纵横坐标的乘积越大,Ksp(AgX)越小,则a、d点在AgCl的沉淀溶解平衡曲线上,b点在AgBr在沉淀溶解平衡曲线上,据此判断。
A.Kw只受温度的影响,a、c在相同的温度下,则Kw相同,故A正确;
B.b点在AgBr在沉淀溶解平衡曲线上,不能计算AgCl的溶度积,故B错误;
C.向饱和AgCl溶液中加入NaCl固体,氯离子浓度增大,平衡逆向移动,阴离子浓度减小,可使a点变到d点,故C正确;
D.AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K=c(Cl-)/c(Br-)=c(Cl-)c(Ag+)/c(Br-)c(Ag+)=Ksp(AgCl)/Ksp(AgBr),故D正确。
AgBr(s)+Cl-(aq)平衡常数K=c(Cl-)/c(Br-)=c(Cl-)c(Ag+)/c(Br-)c(Ag+)=Ksp(AgCl)/Ksp(AgBr),故D正确。
故答案选B。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,将224LHCl气体溶解于635mL水中,所得盐酸的密度为:1.18gcm﹣3。试计算:
(1)所得盐酸的质量分数和物质的量浓度是多少?___、___
(2)取出这种盐酸100mL,稀释至1.18L,求所得稀盐酸的物质的量浓度。___
(3)将含有少量Na2CO3的NaOH样品2.53g,加入50.0mL2.00molL﹣1的盐酸中,充分反应后,生成标准状况下二氧化碳气体112mL,溶液酸性,中和多余的酸又用去40.0mL1.00molL﹣1的NaOH溶液.蒸发中和后的溶液,最终得到多少克固体?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
反应速率最快的是
A. v(A)=0.20mol·L-1·min-1 B. v(B)=0.30 mol·L-1·min-1
C. v(C)=0.40 mol·L-1·min-1 D. v(D)=0.50 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100mL的Na2CO3和Na2SO4混合溶液,加入过量的BaCl2后得29.02g白色沉淀,用过量稀硝酸处理后沉淀量减少到9.32g,并有气体放出,试计算:
(1)原混合溶液中Na2CO3的物质的量浓度__________________;
(2)产生的气体在标准状况下的体积__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用蒸馏水稀释10mLpH=11的氨水。下列叙述正确的是( )
A.该10mL氨水的浓度为0.001mol/L
B.稀释至100mL时,溶液的pH小于10
C.稀释时,溶液中所有的离子的浓度均变小
D.稀释过程中,![]() 的值一定增大
的值一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示各步变化,A为金属,B为淡黄色固体,且每一物质均含有A元素。

(1)试推断以下物质:
B.____________,C.____________,D.____________,E.____________(填化学式)。
(2)写出B→C的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月5日美国商务部表示,美方将采取“空前行动”,确保对科技业和军方极其关键的战略性矿物及稀土供应无虞。我国稀土出口量世界第一。以氟碳铈矿(主要含CeFCO3,少量其他稀土盐LnFCO3、非稀土元素Fe、Al、Mg和SiO2等)为原料制备CeO2的一种工艺流程如图所示:

(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_________________________________。“氧化焙烧”时,CeFCO3和其他稀土盐LnFCO3分别转化为CeO2和Ln2O3,请写出生成的CeO2化学方程式为:________________________。
(2)“氯化”过程的目的是将CeO2和Ln2O3分别转化为可溶性的CeCl3和LnCl3,除去Fe2O3、Al2O3、MgO、SiO2等杂质。若溶液中c(Ce3+)=0.01mol/L,为确保不析出Ce(OH)3沉淀,则溶液的pH________(填pH的范围)。(已知Ksp[Ce(OH)3=1.0×10-20])
(3)CeO2和Ln2O3混合物中加入稀盐酸,Ln2O3溶解生成LnOCl的化学方程式为:___________________________________________________。
(4)化工生产条件的选择:
①“氯化”条件的选择
将氧化焙烧后氟碳铈矿和氯化铵按1:3、1:4、1:5、1:6、1:7质量比混合,在325℃下真空焙烧60min。稀土矿氧化物转化成稀土氯化物的氯化率如图所示:

氧化焙烧后氟碳铈矿和氯化铵的最佳质量比为________。
②“氧化”条件的选择
氧化过程中,反应温度、反应时间对混合稀土氯化物氧化率的关系如图所示:

最佳温度和时间是_________,原因是_________________________________________。
(5)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000molL-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗25.00mL标准溶液.该产品中CeO2的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a克块状碳酸钙与足量盐酸反应,固体反应物消耗的质量m随时间t的变化曲线如下图实线所示。在相同条件下,将b克(a>b)粉末状碳酸钙与足量的溶质质量分数相等的盐酸反应,则相应的曲线(图中虚线所示)正确的是 ( )
A.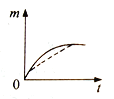 B.
B.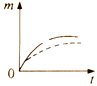 C.
C.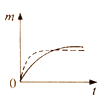 D.
D.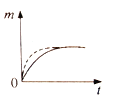
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,世界上生产的镁有60%来自海水,其生产流程图如下:
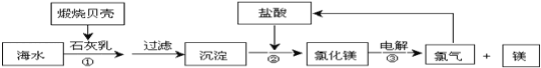
(1)贝壳的主要化学成分为_________(写化学式)。
(2)写出反应②的离子方程式:_____________。
(3)根据流程图可知,可循环利用的物质是__________。
(4)Mg与CO2反应时,有白色粉末并有黑色固体生成。请写出Mg与CO2反应的化学方程式,并用双线桥标出电子转移的方向与数目________。氧化剂是___________,氧化产物是_________。
(5)Na比Mg和Al要活泼,将Na投入到Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com