
【题目】取100mL的Na2CO3和Na2SO4混合溶液,加入过量的BaCl2后得29.02g白色沉淀,用过量稀硝酸处理后沉淀量减少到9.32g,并有气体放出,试计算:
(1)原混合溶液中Na2CO3的物质的量浓度__________________;
(2)产生的气体在标准状况下的体积__________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图(如图),回答下列问题。

(1)操作Ⅰ中所用的仪器有____。
(2)固体A的成分是___和____。(填名称);操作Ⅲ是____。
(3)如何检验溶液a中主要阴离子____。
(4)回收的铜可以用于制备胆矾(CuSO4·5H2O)。将铜和0.22mol/LH2SO4溶液混合后,在加热的情况下不断通入氧气就可以制得CuSO4,然后将所得的溶液经过“一系列操作”后得到胆矾。写出生成CuSO4的化学方程式:___。
(5)某同学用密度为1.84g/cm3、质量分数为 98%的浓硫配制500mL0.22mol/L的稀硫酸溶液,需要用规格为___mL的量筒量取___mL的浓硫酸。
(6)配制该溶液的过程中,下列操作使得所配得的溶液浓度偏小的是___(填字母)。
A.稀释密度为1.84g/cm3、质量分数为 98%的浓硫酸时,不小心溅出少量硫酸溶液
B.用蒸馏水洗涤烧杯、量筒及玻璃棒,并将洗涤液注入容量瓶中
C.定容时反复上下倒转容量瓶后,发现凹液面最低处低于刻度线,再补加水到刻度线
D.量取密度为1.84g/cm3、质量分数为 98%的浓硫酸时,仰视量筒的刻度线
E.洗涤容量瓶后,立即用来配制溶液
F.稀释浓硫酸结束后立即将溶液转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电导率传感器可绘制电导率曲线图,下图为用0.1mol/LNaOH溶液滴定10mL0.lmol/L盐酸过程中的电导率曲线。下列说法错误的是

A. 电导率传感器能用于判断酸碱中和滴定的终点
B. a、b、c 点的溶液中,离子浓度由大到小顺序为a>b>c
C. d点所示溶液中存在:c(Cl-) +c(OH-) =c(H+) +c(Na+)
D. C点电导率最小是因为此时溶液中导电微粒数目最少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:
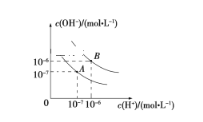
(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________,cH+==__________
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____。
(5)在曲线B对应的温度下,将pH=2的某HA溶液和pH=10的NaOH溶液等体积混合,所得溶液的pH=5。请分析其原因:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳硫、铝、铁是生活中常见的四种元素,根据所学知识回答下列问题:
(1)铁原子基态时核外电子排布式为__,三氯化铁的熔点306℃、沸点315℃,由此判断三氯化铁属于___晶体。
(2)碳的电负性比硫__(填“大”“小”或“相等"),碳、氮、氧元素第一电离能由大到小的顺序为__(填元素符号)。
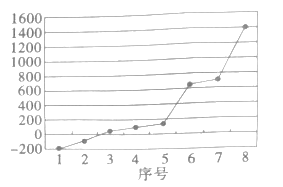
(3)硫元素所在周期的8种元素的单质熔点如图所示,其中序号“8”代表__(填元素符号);形成最高价氧化物对应水化物酸性最强的是__(填图中的序号)。
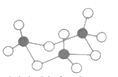
(4)CS2分子的空间构型为__,C原子的价层电子对数为__。
(5)固态SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为__;该分子中含有___个σ键。
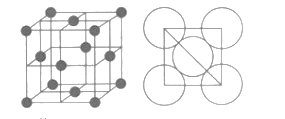
(6)铝单质的晶胞特征及原子之间相互位置关系如图所示,若已知铝的原子半径为dcm,NA代表阿伏加德罗常数,铝的相对原子质量为M,则该晶体的密度为__g/cm3(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_____________________。
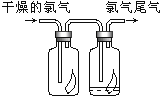
(2)为防止氯气尾气污染空气,实验室通常用______溶液吸收多余的氯气,原理是__________________。
(用化学方程式表示)。
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是______(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______(填字母,下同)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)一旦发生氯气泄漏和爆炸事故,周围群众应紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度某物质水溶液的毛巾捂住鼻子,最适宜采用的该物质是_____________。
A.NaOH B.NaCl C.KCl D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pAg+=lgc(Ag+),pX=lgc(X)。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
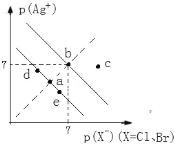
A. a和c两点的Kw相同
B. Ksp(AgCl)=1.0×1014 mol2·L2
C. 向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
D. AgCl(s)+Br(aq)![]() AgBr (s)+Cl(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
AgBr (s)+Cl(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年,我省爆发了新型冠状病毒肺炎疫情,严重影响了人民的健康。茚地那韦或对新型肺炎有治疗效果。茚地那韦的结构简式如图所示。下列有关茚地那韦的说法正确的是
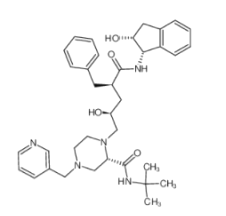
A.分子中含氧官能团有羟基和羧基B.苯环上的一溴代物只有五种
C.可以发生取代反应和加成反应D.该分子属于合成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由C(石墨)=C(金刚石)ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
C. 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)![]() 2H2O(l) ΔH=+285.8 kJ·mol-1
2H2O(l) ΔH=+285.8 kJ·mol-1
D. 在稀溶液中:H++OH-![]() H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com