
(11分)甲醇可作电池的原料,也会造成环境污染。请根据有关反应回答问题。
(1)以CH4和H2O为原料,通过下列反应可制备甲醇。
①CH4(g)+H2O(g) CO(g)+3H2(g) △H =+206.0 kJ·mol-1
②CO(g)+2H2(g) CH3OH (g) △H=-129.0 kJ·mol-1
则CH4(g)+H2O(g) CH3OH (g)+H2(g)的△H= kJ·mol-1。
(2)将1.0 mol CH4(g)和2.0 mol H2O(g)通入容积为10 L的容器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。设100℃时达到平衡所需的时间为5 min,
则这时间段v(H2)= mol·L-1·min-1。

(3)在一定温度下,将一定量CO和H2充入密闭容器发生反应②。达到平衡后,若压缩容器体积至原来的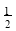 ,对平衡体系产生的影响是 (填序号)。
,对平衡体系产生的影响是 (填序号)。
①c ( H2 )减小 ②CH3OH 的物质的量增加 ③新平衡时, 减小,
减小,
④正反应速率加快,逆反应速率减慢 ⑤平衡常数K增大
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,则:

①Co2+在阳极的电极反应式为 ;
②请完成除去甲醇的离子方程式:Co3++CH3OH+ = Co2++CO2↑+6H+
(1)(2分)+77.0 (2)0.03 (3)②③
(4)①Co2+-e-= Co3+(或6Co2+-6e-=6Co3+) ② 6 H2O 6
【解析】
试题分析:(1)根据盖斯定律,反应CH4(g)+H2O(g)CH3OH (g)+H2(g)将①+②可得,则△H=(+206.0KJ/mol)+(-129.0KJ/mol)=-77KJ/mol;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平衡反应速率V(H2)= =0.03 molL-1min-1;
=0.03 molL-1min-1;
(3)在一定条件下,将一定量的CO和氢气的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;平衡后将容器的容积压缩到原来的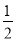 ,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行。①体积减小,c(H2)增大,错误;②体积减小,压强增大,平衡正向移动,CH3OH的物质的量增加,正确;③体积减小,压强增大,平衡正向进行,重新平衡时c(H2)/c(CH3OH)减小,正确;④压强增大,正逆反应速率都加快,错误;⑤平衡常数K只随温度的变化而变化,错误;故选②③;(4)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行。①体积减小,c(H2)增大,错误;②体积减小,压强增大,平衡正向移动,CH3OH的物质的量增加,正确;③体积减小,压强增大,平衡正向进行,重新平衡时c(H2)/c(CH3OH)减小,正确;④压强增大,正逆反应速率都加快,错误;⑤平衡常数K只随温度的变化而变化,错误;故选②③;(4)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
考点:考查电化学基础、化学平衡的影响因素。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
物质 组别 | 甲 | 乙 | 丙 |
A | FeCl2 | Cl2 | NaOH |
B | SiO2 | NaOH | HF |
C | AlCl3 | KOH | H2SO4 |
D | SO2 | NaOH | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列叙述正确的是
A.由于相对分子质量:HCl>HF,故沸点:HCl>HF
B.硅处于金属与非金属的过渡位置,硅可用作半导体材料
C.由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在
D.Cl-、S2-、Ca2+、K+半径逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列有关离子的检验方法和判断正确的是
A.向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+
B.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+
C.向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32-
D.用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
下面关于Fe(OH)3胶体叙述中不正确的是
A.用光照有丁达尔现象 B.能透过滤纸
C.加入过量盐酸,最后发生聚沉 D.能发生电泳现象
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列电离或离子方程式正确的是
A.亚硫酸的电离方程为:H2SO3H++HSO3-
B.NaHS水解的离子方程式为:HS-+H2OH3O++S2-
C.氯化铵水解的离子方程式为: NH4+ +H2ONH3·H2O+H+
D.Na2CO3水解的离子方程式为:CO32-+2H2OH2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列关于中和滴定的操作错误的是
A.滴定前需要检查滴定管是否漏水
B.用对应加入的溶液润洗的仪器有:酸式滴定管、锥形瓶
C.用标准盐酸测定氨水的浓度,最适宜使用的指示剂是甲基橙
D.已知浓度滴定未知溶液,终点读数时俯视滴定管的刻度,会造成计算值偏低
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列除杂质的方法不可行的是
A.除去NaHCO3溶液中少量的Na2CO3:通入过量的CO2
B.除去FeCl2溶液中少量的FeCl3:加入稍过量铁粉,过滤
C.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
D.用盐酸除去AgCl中少量的Ag2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广雅等四校高二上学期期末联考化学试卷(解析版) 题型:选择题
下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1 mol/L Na2CO3溶液:c(OH-) = c(HCO3-) + c(H+) + 2c(H2CO3)
B.0.1 mol/L NH4Cl溶液:c(NH4+ ) = c(Cl-)
C.向醋酸钠溶液中加适量醋酸,得到的酸性混合溶液:c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到pH = 5的混合溶液:c(Na+) = c(NO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com