
下列关于中和滴定的操作错误的是
A.滴定前需要检查滴定管是否漏水
B.用对应加入的溶液润洗的仪器有:酸式滴定管、锥形瓶
C.用标准盐酸测定氨水的浓度,最适宜使用的指示剂是甲基橙
D.已知浓度滴定未知溶液,终点读数时俯视滴定管的刻度,会造成计算值偏低
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:填空题
(14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式_____________________________。
b、上述反应中SiO2起何作用?______________________________________。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1= 7.1×103 K2 = 6.3×108 K3 =4.2×1013 lg7.1≈0.9 lg6.3≈0.8 lg≈0.6) 。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.澄清的石灰水跟盐酸反应:H++OH-== H2O
B.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑
C.NaHCO3溶液与NaOH溶液反应: OH-+ HCO3-=CO32-+ H2O
D.金属钠跟水反应: Na+2H2O ==Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:填空题
(11分)甲醇可作电池的原料,也会造成环境污染。请根据有关反应回答问题。
(1)以CH4和H2O为原料,通过下列反应可制备甲醇。
①CH4(g)+H2O(g) CO(g)+3H2(g) △H =+206.0 kJ·mol-1
②CO(g)+2H2(g) CH3OH (g) △H=-129.0 kJ·mol-1
则CH4(g)+H2O(g) CH3OH (g)+H2(g)的△H= kJ·mol-1。
(2)将1.0 mol CH4(g)和2.0 mol H2O(g)通入容积为10 L的容器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。设100℃时达到平衡所需的时间为5 min,
则这时间段v(H2)= mol·L-1·min-1。

(3)在一定温度下,将一定量CO和H2充入密闭容器发生反应②。达到平衡后,若压缩容器体积至原来的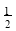 ,对平衡体系产生的影响是 (填序号)。
,对平衡体系产生的影响是 (填序号)。
①c ( H2 )减小 ②CH3OH 的物质的量增加 ③新平衡时, 减小,
减小,
④正反应速率加快,逆反应速率减慢 ⑤平衡常数K增大
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,则:

①Co2+在阳极的电极反应式为 ;
②请完成除去甲醇的离子方程式:Co3++CH3OH+ = Co2++CO2↑+6H+
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子能在指定环境中大量共存的是
A.pH=13的溶液:SO32-、Na+、AlO2-
B.使甲基橙溶液变红色的溶液:Na+、SO42-、HCO3-
C.在c(H+)=10-12mol/L的溶液:NH4+、Cl-、NO3-
D.加入足量Na2O2后的溶液:K+、Cl-、ClO-
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:实验题
(14分)实验题:
某实验小组拟验证CO2与Na2O2反应的产物,现设计以下实验装置进行实验:

(1)写出装置A中反应的化学方程式__________________________________;
写出装置B中反应的化学方程式__________________________________。
(2)拟用装置D收集气体产物,请在方框中将装置补充完整。

(3)产物检验:
①检验气体产物的方法:________________________________________;
检验固体产物的方法:从B装置中取少量固体,溶于水配成溶液,____________________________________________________________。
(4)有同学认为该实验装置存在明显缺陷,你认为该缺陷是什么____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
以下关于混合物分离提纯操作或原理说法正确的是
A.实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法
B.用CCl4萃取碘水的实验中,振荡静置后,下层为紫红色溶液
C.利用植物油的密度比水小的原理,可用分液的方法分离这两种液体混合物
D.蒸馏时,温度计的水银球应充分接触溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:填空题
(14)CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.5 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。

①写出该反应的化学方程式_______________________计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。(双选、填序号)
A.在原容器中再充入1 mol H2 B.在原容器中再充入1 mol CO2
C.缩小容器的容积 D.使用更有效的催化剂
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。

①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值____(填“增大”、“减小”或“不变”)。
在一定温度下,增大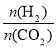 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广雅等四校高二上学期期末联考化学试卷(解析版) 题型:选择题
下列溶液一定呈中性的是
A.pH = 7的溶液
B.Kw = c(H+)·c(OH-) = 1.0×10-14的溶液
C.c(H+) = c(OH-)
D.pH = 3的酸与pH = 11的碱等体积混合后的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com