


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
A、N2的电子式: | ||
B、S2-的结构示意图: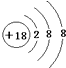 | ||
C、质子数为53、中子数为78的碘原子:
| ||
| D、16O2与18O3互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
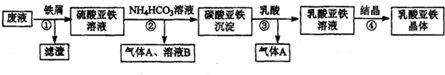
查看答案和解析>>
科目:高中化学 来源: 题型:

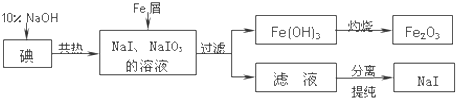
查看答案和解析>>
科目:高中化学 来源: 题型:
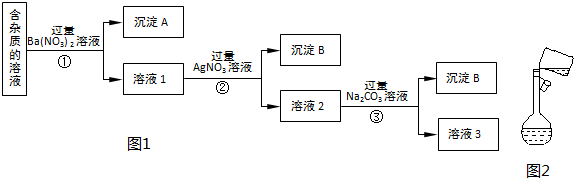
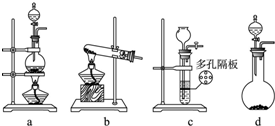
查看答案和解析>>
科目:高中化学 来源: 题型:
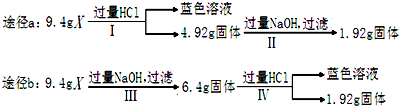
| A、由Ⅰ可知X中一定存在Fe2O3、Cu | ||
| B、由Ⅱ和Ⅲ可得出结论,混合物中无Al2O3 | ||
| C、1.92g固体为SiO2和Cu的混合物 | ||
D、原混合物中
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| NH3?H2O的Kb | Zn2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
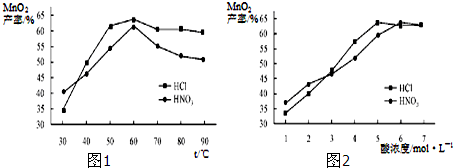
查看答案和解析>>
科目:高中化学 来源: 题型:
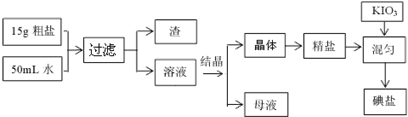
查看答案和解析>>
科目:高中化学 来源: 题型:
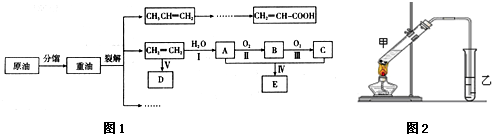
| 催化剂 |
| △ |
| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com