
【题目】下列说法正确的是( )
A.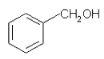 与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B.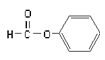 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C.![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有8种
【答案】C
【解析】
A、结构相似、分子组成上相差一个或若干个CH2的化合物间互为同系物,而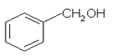 为醇类,
为醇类,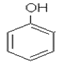 为酚类,故两者结构不相似,不是同系物,故A错误;
为酚类,故两者结构不相似,不是同系物,故A错误;
B、醛基为-CHO,-COO-为酯基,故 属于酯类,故B错误;
属于酯类,故B错误;
C、烯烃命名时,选含官能团的最长的碳链为主链,故主链上有4个碳原子,故为丁烯,从离官能团近的一端给主链上的碳原子进行编号,故碳碳双键在1号和2号碳原子之间,在2号碳原子上有一个乙基,故名称为2-乙基-1-丁烯,故C正确;
D、甲苯苯环上有3种H原子,含3个碳原子的烷基有正丙基、异丙基两种,所以甲苯苯环上的一个氢原子被含3个碳原子的烷基取代产物有3×2=6种,故D错误。
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
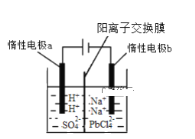
①写出电解时阴极的电极反应式_____________。
②电解过程中通过阳离子交换膜的离子主要为________。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向___________极室(填“阴”或者“阳”)加入____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
若某反应的平衡常数表达式为:K=![]() ,请写出此反应的热化学方程式___。
,请写出此反应的热化学方程式___。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/(mo·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.35 | 0.35 |
反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=__;1.00min~3.00min内,O2的平均反应速率为__。从表中可知化学反应速率变化规律是__。
①该温度下反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用P0表示平衡常数表达式,不用计算)。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.混合气体的密度保持不变
(3)“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析B极发生的电极反应式为__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究某浅黄色固体化合物X(含四种元素)的组成。某化学兴趣小组称取 3.60g 该固体化合物,用热重法对其进行分析,得到剩余固体的质量随温度变化的曲线如图所示。
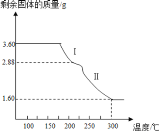
已知:① 热分解后得到的无色无味气体能完全被足量澄清石灰水吸收,并得到 4.00g白色沉淀;
② 热分解后剩余的固体呈红棕色,溶于盐酸后得到黄色溶液。请回答:
(1)X 的化学式是_____。
(2)固体X 在 300℃下反应的化学方程式是_____。
(3)将热分解后剩余的红棕色继续升温加热至一定温度,可生成1.55g黑色固体(纯净物),请设计实验方案检验黑色固体中的阳离子_____。
(4)该兴趣小组进一步查阅资料发现,在隔绝空气加热条件下,该化合物 X 还生成黑色能自燃并且具有铁磁性的粉末。则其可能发生的化学方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释到100 mL,在稀释后的溶液中分别逐滴加0.1 mol/L的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示:

(1)原NaOH溶液的物质的量浓度_________________。
(2)B份混合溶液与盐酸反应产生气体的最大体积为________mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到联氨(N2 H4)的水溶液中,混合溶液中pOH[pOH=- lgc(OH- )]随离子浓度变化的关系如图所示。下列叙述正确的是(已知N2H4在水溶液中的电离方程式:N2H4+H2O- ![]() N2H5++OH- ,N2H5+ +H2O-
N2H5++OH- ,N2H5+ +H2O- ![]() N2H62++OH- )
N2H62++OH- )
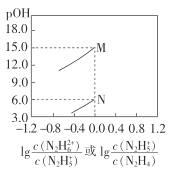
A.联氨的水溶液中不存在H+
B.曲线M表示pOH与![]() 的变化关系
的变化关系
C.反应N2H4+H2O![]() N2H5++OH-的K=10-6
N2H5++OH-的K=10-6
D.N2H5Cl的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钒(VO2)是一种新型热敏材料。实验室以V2O5为原料合成用于制备VO2的氧钒( IV )碱式碳酸铵晶体,过程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() (NH4)5[(VO)6(CO3)4(OH)9]10·H2O
(NH4)5[(VO)6(CO3)4(OH)9]10·H2O
回答下列问题:
(1)步骤i中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为____。也可只用浓盐酸与V2O5来制备VOCl2溶液,从环境角度考虑,该方法的缺点是_______。
(2)步骤ii可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。

①药品填装完成后的实验操作是____(填活塞“a”“b”的操作)。
②若无装置B,则导致的后果是____。
(3)加完VOCl2后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,除去水分,再用乙醚洗涤2次,抽干称重。用饱和NH4 HCO3溶液洗涤除去的阴离子主要是____。
(4)测定氧钒( IV )碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加0.02 mol·L-1的KMnO4溶液至稍过量,充分反应后继续加1% NaNO2溶液至稍过量,再用尿素除去过量的NaNO2 ,最后用0.08 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00 mL。(滴定反应:VO2+ + Fe2++2H+=VO2++ Fe3++H2O)
①NaNO2溶液的作用是____。
②粗产品中钒的质量分数为____(精确到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的有( )个
①20℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有NA个电子转移
②64g灼热的铜丝在硫黄蒸气里完全反应后,失去的电子数为2NA
③标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4 L
④7.8g Na2S与Na2O2的混合物中阴离子数大于0.1NA
⑤0℃,101kPa,含有lmol硫原子的SO2与SO3的混合物,其体积小于22.4L
⑥常温常压下,17g甲基(-14CH3)所含的中子数为9NA
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应ΔH>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下:
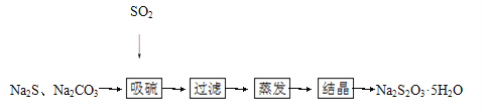
(1)吸硫装置如图所示:
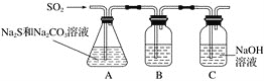
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是____________,表明SO2吸收效率低的实验现象是B中_________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是________、________。(写出两条)
(2)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取ag KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL。则c(Na2S2O3)=_________ mol·L-1。(只列出算式,不作运算)已知:![]() +I2=
+I2=![]() +2I-
+2I-
(3)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 ____(填“无影响”、“偏低”或“偏高”),原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com