
【题目】常温下,将盐酸滴加到联氨(N2 H4)的水溶液中,混合溶液中pOH[pOH=- lgc(OH- )]随离子浓度变化的关系如图所示。下列叙述正确的是(已知N2H4在水溶液中的电离方程式:N2H4+H2O- ![]() N2H5++OH- ,N2H5+ +H2O-
N2H5++OH- ,N2H5+ +H2O- ![]() N2H62++OH- )
N2H62++OH- )
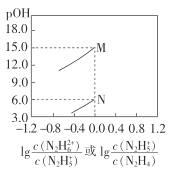
A.联氨的水溶液中不存在H+
B.曲线M表示pOH与![]() 的变化关系
的变化关系
C.反应N2H4+H2O![]() N2H5++OH-的K=10-6
N2H5++OH-的K=10-6
D.N2H5Cl的水溶液呈碱性
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
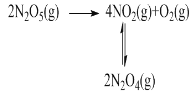
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解)
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() =2.9 kPa,则此时的
=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是_________。
④25℃时N2O4(g)= 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
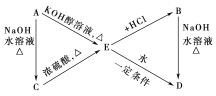
【题目】已知:R—CH=CH2+HX→![]() (主要产物)。下列转化中A、B分别是分子式为C3H7Cl的两种同分异构体,请根据转化关系和反应条件,判断并写出:
(主要产物)。下列转化中A、B分别是分子式为C3H7Cl的两种同分异构体,请根据转化关系和反应条件,判断并写出:
(1)A、B、C、D、E的结构简式____、____、____、____、____。
(2)由E转化为B、由A转化为E的化学方程式____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol·L-1KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
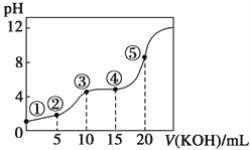
(1)点①所示溶液中,Kw=__________。
(2)点②所示溶液中的电荷守恒式为______________________________________。
(3)点③所示溶液中存在________种平衡。
(4)点④所示溶液中的物料守恒式为0.10 mol·L-1=___________________________。
(5)点⑤所示溶液中各离子浓度的大小顺序为________________________________。
(6)上述5点所示溶液中,水的电离程度最大的是_______,最小的是________(用序号回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.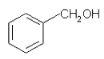 与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B.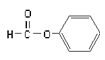 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C.![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的原因或结论与现象不对应的是( )
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL0.010mol·L-1KSCN溶液,溶液呈红色,再滴加1ml1 mol·L-1KCl溶液,溶液颜色变浅 | 增大生成物浓度,平衡向逆反应方向移动 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 在密闭容器中有反应:A+xB(g) | 若A为气体、x>1 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用有机物苯实现电化学储氢的原理如下图所示。下列说法中不正确的是( )
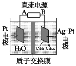
A.Ag-Pt极的电极反应式为:C6H6+6H++6e-== C6H12
B.总反应式为2C6H6+6H2O→2C6H12+3O2↑
C.通电后H+离子由左池向右池迁移
D.当电路中通过1mol电子的电量时,会有0.25molO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
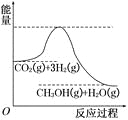
(1)上述反应平衡常数K的表达式为_______________,温度降低,平衡常数K_______(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=_______。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是_______(填写序号字母)
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g) ![]() 3Z(g)+Q(s) △H>0,下列叙述正确的是
3Z(g)+Q(s) △H>0,下列叙述正确的是
A.当容器中X与Y的物质的量之比满足1∶2时反应达到平衡
B.达到平衡时X的转化率为25%,则平衡常数K为9/4
C.达到平衡后,反应速率2v正(Y)=3v逆(Z)
D.达到平衡后,加入Q,平衡逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com