
(18分)硫代硫酸钠在工业生产中用途非常广泛。
(1)Na2S2O3溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
(2)Na2S2O3可以用作氰化物的解毒剂,工业上常用硫化碱法制备Na2S2O3,反应原理为:
2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
①装置B的作用是检验装置A中SO2的吸收效率,则B中试剂是________________,表明SO2吸收效率低的实验现象是B中溶液________________________。
②实验结束时,测得装置C中的溶液含有两种溶质,其中一种为NaOH,则实验过程中该装置内发生反应的化学方程式是_________________________;若两种溶质的物质的量相等,则该溶液所含离子浓度的大小顺序为__________________________________。
③假设本实验所用的Na2CO3含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
已知:室温时CaCO3饱和溶液的pH=10.2。
限选试剂及仪器:稀硝酸、AgNO3溶液、CaC12溶液、酚酞溶液、蒸馏水、pH计,烧杯、试管、胶头滴管。
(1)500mL容量瓶、胶头滴管(2分)
(2)①品红或溴水或KMnO4溶液(2分,其他合理答案也给分)溶液颜色很快褪去(2分)
②2NaOH+CO2 ="=" Na2CO3+H2O (3分)c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+)(3分)
③Ⅰ.有白色沉淀生成 Ⅱ.加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH(3分)
解析试题分析:(1)实验室需用480mL一定浓度的Na2S2O3溶液,根据实验步骤确定仪器,溶解用到烧杯和玻璃棒,移液要用到容量瓶,实验室中没有480mL的容量瓶,故应选500mL的容量瓶,定容需要胶头滴管;答案为:500mL的容量瓶、胶头滴管;(2)①二氧化硫具有还原性、漂白性,装置B的作用是检验装置A中SO2的吸收效率,则B中试剂可以用品红溶液、溴水或KMnO4溶液,来检验二氧化硫是否被完全吸收,若SO2吸收效率低,则二氧化硫有剩余,B中的溶液褪色,答案为:品红、溴水或KMnO4溶液;溶液颜色很快褪色;②根据题给反应知,进入装置C中的气体一定含有二氧化碳,C中溶液含有两种溶质,其中一种为NaOH,则实验过程中该装置内发生反应的化学方程式是2NaOH+CO2 ="=" Na2CO3+H2O;若两种溶质的物质的量相等,则该溶液所含离子浓度的大小顺序为c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+)。③实验所用的Na2CO3含少量NaCl、NaOH,若检验NaCl存在,需先加稀硝酸排除Na2CO3和NaOH干扰,再加硝酸银溶液,若有白色沉淀生成,说明有NaCl;已知室温时CaCO3饱和溶液的pH=10.2,若要检验氢氧化钠存在,需加入过量CaCl2溶液,把Na2CO3转化为CaCO3,再测量溶液的pH,若pH大于10.2,说明含有NaOH,答案为:Ⅰ.有白色沉淀生成 Ⅱ.加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH。
考点:考查一定物质的量浓度溶液的配制,实验方案的分析、评价和设计。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列有关化学实验的说法中正确的是
| A.烧杯、坩埚、试管、锥形瓶都可以用酒精灯直接加热 |
| B.银镜反应、乙醛与新制Cu(OH)2反应、实验室制取乙烯都必须用水浴加热 |
| C.制取氨气、氢气时都可以用向下排空气法收集 |
| D.石油的分馏、实验室制取乙炔和制取蒸馏水都要用到冷凝装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO ? Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O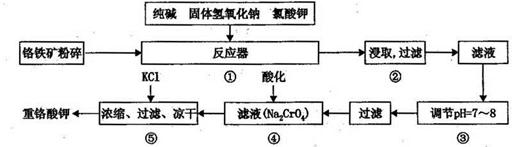
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:_______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下: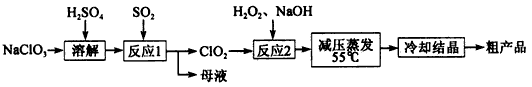
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下:
(1)仪器A为 (填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为 。
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42—+ MnO4—+ = Mn2++ CO2↑+
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是 。
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00ml,已知滴定后的液面如图所示,请在图中标出滴定前的液面。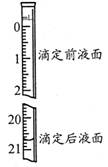
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl—影响
猜想2:配制Na2C2O4标液定容时 。
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl—影响。(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) 。
资料卡片:
1、有机质可HNO3被氧化。
2、AgCl不与酸性KMnO4溶液反应。
3、Ag2C2O4可被酸性KMnO4溶液氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究小组甲欲用KMnO4测定FeSO4的含量。
(1)①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液200 mL,配制时需要的仪器除天平、药匙外,还需要的仪器有_____、_____、_____、_____、_____。
②用KMnO4(酸化)滴定时,含硫酸亚铁的溶液放在_____(填仪器)中,高锰酸钾溶液放在______(填仪器)中,滴定终点时溶液的颜色为_____色。
(2)另一研究小组乙设计了如下测量方案: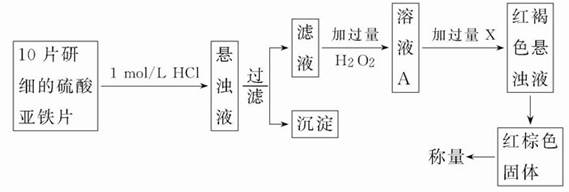
①过滤时用到的玻璃仪器有________________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有_____(按操作的顺序填写)。
A过滤;B洗涤;C萃取;D分液;E冷却;F灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)酸性条件下高锰酸钾溶液分解的离子方程式 。
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
______MnO4— +______C2O42—+______H+=______Mn2++______CO2↑+____________
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组对用酸化的硝酸银溶液检验I-存在的合理性产生了兴趣,同学们根据变量控制思想进行如下方案设计并进行了实验探究:
[提出假设]
假设1:生成的AgI不溶于水,不能被HNO3氧化。
假设2:HNO3有氧化性,能将I-氧化成I2。
[设计实验方案,验证假设]
(1)甲同学向KI溶液中滴加硝酸化的AgNO3溶液并振荡,有黄色沉淀生成。验证了假设1成立。请写出有关化学方程式 。
(2)乙同学设计实验验证2,请帮他完成下表中内容。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| | 若溶液变蓝,假设2成立。 若溶液不变蓝,假设2不成立。 |
| …… |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com