
(14分)水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下:
(1)仪器A为 (填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为 。
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42—+ MnO4—+ = Mn2++ CO2↑+
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是 。
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00ml,已知滴定后的液面如图所示,请在图中标出滴定前的液面。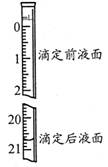
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl—影响
猜想2:配制Na2C2O4标液定容时 。
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl—影响。(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) 。
资料卡片:
1、有机质可HNO3被氧化。
2、AgCl不与酸性KMnO4溶液反应。
3、Ag2C2O4可被酸性KMnO4溶液氧化。
(14分)
(1)酸式(2分) 紫红色(2分)
(2)5C2O42-+2MnO4?+16H+ = 2Mn2++10CO2+8H2O(2分)
随着反应的进行,生成的Mn2+可做该反应的催化剂(2分)
(4)俯视刻度线(2分,答“视线不水平”或“读数不准确”给1分;答“仰视刻度线”不给分)
(5)在步骤出I的水样中加入适量的Ag2SO4溶液(2分,其它合理答案也可给分)
解析试题分析:(1)KMnO4具有强氧化性,应盛放在酸式滴定管中;KMnO4溶液的颜色为紫红色。
(2)根据氧化还原反应化合价升高的总价数等于化合价降低的总价数,Mn由+7价转化为+2价,降低5价,C2O42-中C为+3价,转化为CO2,共升高了2价,配平可得:5C2O42-+2MnO4?+16H+ = 2Mn2++10CO2+8H2O;滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,化学反应速率加快的原因为:随着反应的进行,生成的Mn2+可做该反应的催化剂。
(3)所用Na2C2O4溶液为20.00ml,所以滴定前的液面向上移动20.00ml。
(4)定容时俯视刻度线,溶液的体积偏小,所配制溶液的浓度偏大,所以实验测量结果比实际有机物含量偏高。
(5)若猜想1成立,若消除Cl—影响,需要除去Cl?,AgNO3溶液、KMnO4溶液、Na2C2O4溶液会发生氧化还原反应造成误差,所以选用Ag2SO4溶液除去Cl?。
考点:本题考查基本仪器、基本操作、氧化还原反应的配平、误差分析、除杂。


科目:高中化学 来源: 题型:单选题
下列实验操作中正确的是( )
| A.用干燥的pH试纸测定某氯水的pH |
| B.做完银镜反应的试管可以用氨水来洗涤 |
| C.为了除去乙酸乙酯中混有的少量乙酸,加入足量氢氧化钠溶液,充分搅拌后分液 |
| D.如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一。
(1)下列有关叙述正确的是__________(填写序号)
a.使用托盘天平的第一步操作是将游码移至标尺零刻度处
b.过滤操作过程中,为加快过滤速度可用玻璃棒对漏斗中的溶液进行搅拌
c.用浓硫酸配制稀溶液时,在量筒中衡稀后要冷却至室温再转移到容量瓶中
d.用容量瓶配制溶液时,定容后摇匀液面下降,再加蒸馏水至刻度线处,所得溶液浓度偏低
(2)现有六种气体:H2、O2、NH3、SO2、NO2、NO。可以利用如图所示装置进行收集。
①若气体从B口进入,可收集的气体是_______________;
②若在烧瓶中注满水,则气体应该从___(填写“A”或“B”)口进入,可以收集的气体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
利用反应I2(s)+Cl2(g)=2ICl(l),实验室可用如下图所示装置(加热、夹持仪器已略去)制取少量IC1。
已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:
ICl(l)+Cl2(g)=2ICl3(l)
(1)装置A中发生反应的化学方程式是____________。
(2)装置B的作用是______。不能用装置F代替装置E,理由是____________。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(11分)某化学小组设计实验探究碳酸钠、碳酸氢钠的性质,实验如下:取两支试管分别加入10 mL相同浓度的稀盐酸,将两个各装有0 5 g的Na2CO3和NaHCO3粉末的小气球分别套在两个试管上,将气球内的固体粉末同时倒人试管中,已知盐酸足量,观察实验现象。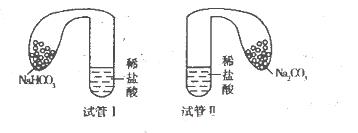
(l)两支试管中均产生气体,其中产生气体较快的为________(填“试管I”或“试管II”),投入________(填化学式)的试管中气球变得比较大。
(2)甲同学触摸上述两试管,发现试管I变冷,试管Ⅱ变热,由此提出不管其状态如何,NaHCO3与HCl反应为吸热反应,Na2CO3与HCl反应为放热反应。
为进一步探究Na2CO3、NaHCO3与盐酸反应的能量变化,乙同学进行下列实验,操作步骤为:①向试剂1中加入试剂2,搅拌、测定温度;②静置、测定温度;③再加入试剂3.搅拌、测定温度、记录。得到以下数据: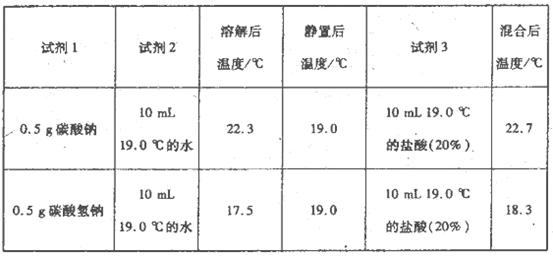
上述实验需要用到的玻璃仪器有________。
乙同学可得出结论:
①NaHCO3的溶解过程________(填“吸热”或“放热”,下同);Na2CO3的溶解过程________。
②CO32-与H+反应为一反应(填“放热”或“吸热”,下同),HCO3-与H+反应为________反应。
(3)比较甲乙同学的实验,你认为 ________(填“甲”或“乙”)的实验方案更合理、更严密。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(18分)硫代硫酸钠在工业生产中用途非常广泛。
(1)Na2S2O3溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
(2)Na2S2O3可以用作氰化物的解毒剂,工业上常用硫化碱法制备Na2S2O3,反应原理为:
2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
①装置B的作用是检验装置A中SO2的吸收效率,则B中试剂是________________,表明SO2吸收效率低的实验现象是B中溶液________________________。
②实验结束时,测得装置C中的溶液含有两种溶质,其中一种为NaOH,则实验过程中该装置内发生反应的化学方程式是_________________________;若两种溶质的物质的量相等,则该溶液所含离子浓度的大小顺序为__________________________________。
③假设本实验所用的Na2CO3含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
已知:室温时CaCO3饱和溶液的pH=10.2。
限选试剂及仪器:稀硝酸、AgNO3溶液、CaC12溶液、酚酞溶液、蒸馏水、pH计,烧杯、试管、胶头滴管。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
化学实验在化学学习中具有重要的作用。
(1)下列与实验有关的叙述正确的是 (填序号)。
①氨水、浓硝酸和溴化银都必须存放在配有磨口塞的棕色玻璃瓶中
②容量瓶、分液漏斗、酸(碱)式滴定管等仪器在使用前都必须检验是否漏水
③用稀盐酸即可鉴别Na2SiO3、NaHCO3、Na[Al(OH)4]、Na2SO4四种溶液
④乙酸与乙醇的混合液可用分液漏斗进行分离
⑤用托盘天平准确称取29.25gNaCl固体,配制500mL0.5mol·L-1 NaCl溶液
(2)实验室用Fe2O3与CO反应来制取单质Fe。
①请按气流方向连接下列所有装置(每种装置只允许使用一次),合理的顺序为A 。
。
②装置C的作用是 。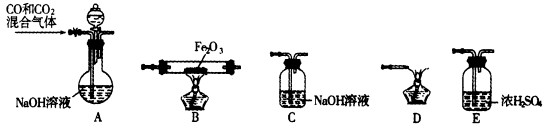
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现。这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,然后立即转变为普通氧分子,多余的能量以红光放出。本实验所用的仪器及导管如图。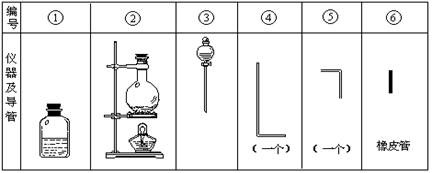
根据要求填写下列空白:
(1)组装氯气发生装置时,应选用的仪器及导管为 (填写图中编号)。
(2)本实验进行时,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次为 。
(3)仪器①的橡皮塞上至少应有2个孔的原因是 。
(4)本实验需配置10mol·L-1的NaOH溶液500mL,用到的仪器除了托盘天平、烧杯外,还须用到的仪器有 (填仪器名称) ,定容时操作如图,则所配溶液浓度 (填“偏高”或“偏低”)。
(5)实验时仪器①中ClO-与H2O2反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某Na2CO3样品中混有一定量的Na2SO4 (设均不含结晶水),某化学兴趣小组采用两种方案测定该样品中Na2CO3的质量分数,试回答下列问题。
方案一:利用下列方案完成Na2CO3质量分数的測定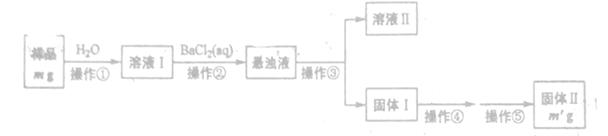
(1)操作③和④的名称分别为_______。
(2)上述操作①~④中,使用到玻璃棒的有______(填操作序号)。
(3)判断操作②否完成的方法是______
方案二:采用下图实验装置(夹持仪器已省略).选用下列试剂: a.浓硫酸b.饱和NaHCO3溶液C.6mol/L盐酸D.2mol/L硫酸, e.碱石灰f. 无水CaCl2,測定样品中Na2CO3,的质量分数: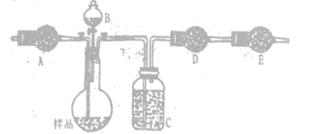
(4)填写表中空格:
| 仪器 | 试剂 | 加入该试剂的目的 |
| A | | 鼓入空气时洗去CO2 |
| B | | 使样品充分反应放出气体 |
| C | a | |
| D | e | 充分吸收CO2 |
| E | e | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com