
���� ��1����Ӧ����ʽΪ��N2H4+2H2O2=N2+4H2O������0.4molҺ̬�·ų�������������1molҺ̬�·ų�������������д���Ȼ�ѧ����ʽ��
��2�����ݸ�˹���ɺϲ�д������Һ̬ˮʱ���Ȼ�ѧ����ʽ���м��㣻
��3�����ݷ�ӦN2H4��g��+2H2O2��l��=N2��g��+4H2O��g���IJ����ǵ�����ˮ�����÷�Ӧ���ŵ㣻
��4���״�ȼ�ϵ�طŵ�ʱ��CԪ�صĻ��ϼ����ߣ����Լ״����ڵ缫Ϊԭ��صĸ�����OԪ�صĻ��ϼ۽��ͣ�����ͨ�������ļ�Ϊԭ��ص������������Ϸ���������Ӧ�������Ϸ�����ԭ��Ӧ���Դ������
��� �⣺��1����Ӧ����ʽΪ��N2H4+2H2O2�TN2+4H2O��0.4molҺ̬�·ų�256.652KJ����������1molҺ̬�·ų�������Ϊ$\frac{265.652kJ}{0.4}$=641.63kJ��
���Է�Ӧ���Ȼ�ѧ����ʽΪ��N2H4��g��+2H2O2��l���TN2��g��+4H2O��g����H=-641.63kJ/mol��
�ʴ�Ϊ��N2H4��g��+2H2O2��l��=N2��g��+4H2O��g����H=-641.63kJ/mol��
��2����N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.63kJ/mol��
��H2O��g��=H2O��l����H=-44kJ/mol��
���ݸ�˹���ɢ�+�ڡ�4�õ���N2H4��l��+2H2O2��l���TN2��g��+4H2O��l������H=-817.63kJ/mol��
�Ȼ�ѧ����ʽ��32gȫ����Ӧ����817.63kJ��16gҺ̬��������˫��ˮ��Ӧ���ɵ�����Һ̬ˮʱ���ų�������Ϊ��817.63kJ��$\frac{1}{2}$=408.815kJ��
�ʴ�Ϊ��408.815��
��3����ԭ���£�N2H4����ǿ������H2O2�������ǻ��ʱ�������������ĵ�����ˮ���������ͷŴ��������Ϳ��ٲ������������⣬���к�ͻ�����ŵ��ǣ�����Ϊ������ˮ���������Ⱦ��
�ʴ�Ϊ����������Ⱦ��
��4��CH3OH��O2�ڵ���У��϶���O2����CH3OH��CH3OH�Ǹ�����Ӧ�O2��������Ӧ�CH3OH����������CO2��H2O���������Һ����ǿ�OH-����CO2Ҫת��CO32-��
�ټ״��Ǹ������缫��ӦʽΪ��CH3OH+8OH--6e-�TCO32-+6H2O���ʴ�Ϊ������CH3OH+8OH--6e-�TCO32-+6H2O��
��CH3OH����������CO2��H2O���������Һ����ǿ�OH-������CO2Ҫת��CO32-����ط�ӦΪ��2CH3OH+3O2+4OH-�T2CO32-+6H2O��
�ʴ�Ϊ��2CH3OH+3O2+4OH-�T2CO32-+6H2O��
���� ���⿼�����Ȼ�ѧ����ʽ����д���йط�Ӧ�ȵļ��㣬��Ŀ�Ѷ��еȣ�ע���˹���ɵ�Ӧ�ã�����������ѧ���ķ������������������Ӧ����ѧ֪ʶ��������


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na��NaOH | B�� | FeCl3��FeCl2 | C�� | H2��H2O | D�� | Cu��CuO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
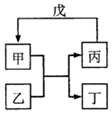 �ס��ҡ�������������ת����ϵ��ͼ��ʾ����Ӧ������ȥ����ͷ��ʾһ��ת���������и������У���������ͼת����ϵ���ǣ�������
�ס��ҡ�������������ת����ϵ��ͼ��ʾ����Ӧ������ȥ����ͷ��ʾһ��ת���������и������У���������ͼת����ϵ���ǣ������� | �� | �� | �� | �� | |
| �� | SiO2 | NaOH | ��Na2SiO3 | ��CO2 |
| �� | Fe | H2O | Fe2O3 | H2 |
| �� | ��Al��OH��3 | NaOH��Һ | NaAlO2��Һ | ����CO2 |
| �� | Na2O2 | CO2 | O2 | Na |
| A�� | �٢� | B�� | �٢� | C�� | �ڢ� | D�� | �٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
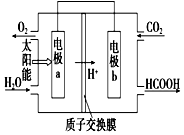 ȼ�ϵ�ʹ�úͷ���Ⱦ����ᷢչ��һ�����رܵ�ì�ܻ��⣮
ȼ�ϵ�ʹ�úͷ���Ⱦ����ᷢչ��һ�����رܵ�ì�ܻ��⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
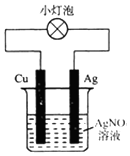
| A�� | ��װ�����·�е�����Cu��ת�Ƶ�Ag�� | |
| B�� | ��װ����������Cu��������Ag | |
| C�� | ��װ�ÿ��Խ�����ת��Ϊ��ѧ�� | |
| D�� | ��װ���������ϵĵ缫��ӦΪAg++e-=Ag |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ��ʣ���ҩƷ���ܷŻ�ԭ�Լ�ƿ | |
| B�� | �ιܲ��ܽ���ʹ�� | |
| C�� | ����ʵ��װ����ʵ��ǰ���������Լ�� | |
| D�� | ��ȼ��������鴿 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com