
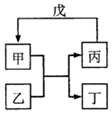
 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| ① | SiO2 | NaOH | Na2SiO3 | CO2 |
| ② | Fe | H2O | Fe2O3 | H2 |
| ③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
分析 根据反应甲+乙→丙+丁,丙+戊→甲分析,将四个选项中的各物质代入,结合物质的性质判断这两个反应是否能发生,如果能发生,则正确,否则错误.
解答 解:①二氧化硅与氢氧化钠反应生成硅酸钠,但硅酸钠与二氧化碳反应生成硅酸不产生二氧化硅,故错误;
②3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,3H2+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O,所以能实现转化,故正确;
③Al2O3+2NaOH=2NaAlO2+H2O,NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 ,所以不能实现转化,故错误;
④2Na2O2+2CO2=2Na2CO3+O2,2 Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,所以能实现转化,故正确;
故选C.
点评 本题考查物质之间的化学反应,明确物质的性质是解本题关键,注意铁和水蒸气反应生成四氧化三铁而不是氧化铁,为易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(PCl3)/mol | 4 | 2.8 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都具有放射性 | |
| B. | 尽管它们结构不同,但它们的化学性质相同 | |
| C. | 它们互为同分异构体 | |
| D. | 它们的原子最外层均为8电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:9:24:14:28 | B. | 1:2:5:3:6 | C. | 8:9:12:10:20 | D. | l:l:l:l:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量、不同密度的C2H4和C3H6 | B. | 同质量、不同体积的CO和N2 | ||
| C. | 同体积、同密度的N2O和CO2 | D. | 同压强、同体积的CO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸酸化的Ba(NO3)2溶液中通入SO2,有白色沉淀生成,则BaSO3难溶于酸 | |
| B. | 液溴应保存在磨口玻璃塞的棕色细口试剂瓶中,并加少量水于液溴上层进行水封 | |
| C. | 向FeI2溶液中加入少量氯水,再加CCl4萃取,CCl4层呈紫红色,Fe2+的还原性强于I- | |
| D. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com