
| A. | 同质量、不同密度的C2H4和C3H6 | B. | 同质量、不同体积的CO和N2 | ||
| C. | 同体积、同密度的N2O和CO2 | D. | 同压强、同体积的CO2和SO2 |
分析 A.二者具有相同的最简式,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$;
B.CO与N2具有相同的摩尔质量,都是双原子分子;
C.N2O和CO2具有相同的摩尔质量,都是三原子分子,依据m=ρV,n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$判断;
D.同压、同体积的CO2和SO2,温度影响气体分子数目.
解答 解:A.C2H4和C3H6,二者具有相同的最简式CH2,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,可知二者质量相同,则具有原子数一定相等,故A不选;
B.CO与N2具有相同的摩尔质量,都是双原子分子,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,可知二者质量相同,则具有原子数一定相等,故B不选;
C.N2O和CO2具有相同的摩尔质量,都是三原子分子,依据m=ρV可知同体积、同密度的N2O和CO2质量相等,则依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,可知二者质量相同,则具有原子数一定相等,故C不选;
D.同压强、同体积的CO2和SO2,温度影响气体分子数目,温度不确定,则无法判断气体分子数关系,含有原子数目不一定相等,故D选;
故选:D.
点评 本题考查原子数的有关计算,以及阿伏加德罗定律及推论,题目难度不大,注意把握物质的量、质量、体积之间的计算公式的运用.


科目:高中化学 来源: 题型:选择题
| A. | 0.1L物质的量浓度为2mol/L的(NH4)2S溶液中含有的S2-数目为0.2×6.02×1023 | |
| B. | 对NaCl溶液和金属钠加热,都会使导电能力增强 | |
| C. | 25℃时,向0.1mol/LCH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 | |
| D. | 用惰性电极电解1L 1mol/L的CuSO4溶液,当阴极析出3.2g铜时,加入0.05mol Cu(OH)2固体可将溶液浓度恢复至元浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
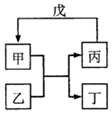 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| ① | SiO2 | NaOH | Na2SiO3 | CO2 |
| ② | Fe | H2O | Fe2O3 | H2 |
| ③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ρ1>ρ2>ρ3>ρ4 | B. | ρ1>ρ2>ρ4>ρ3 | C. | ρ2>ρ1>ρ3>ρ4 | D. | ρ2>ρ1>ρ4>ρ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
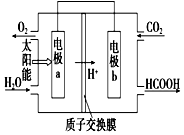 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
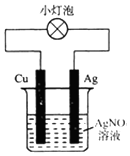
| A. | 该装置外电路中电流由Cu棒转移到Ag棒 | |
| B. | 该装置中正极是Cu、负极是Ag | |
| C. | 该装置可以将电能转化为化学能 | |
| D. | 该装置中正极上的电极反应为Ag++e-=Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com