
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 它们都具有放射性 | |
| B. | 尽管它们结构不同,但它们的化学性质相同 | |
| C. | 它们互为同分异构体 | |
| D. | 它们的原子最外层均为8电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2) | B. | (1)(3) | C. | (1) | D. | (3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸酸化的Ba(NO3)2溶液中通入SO2,有白色沉淀生成,则BaSO3难溶于酸 | |
| B. | 液溴应保存在磨口玻璃塞的棕色细口试剂瓶中,并加少量水于液溴上层进行水封 | |
| C. | 向FeI2溶液中加入少量氯水,再加CCl4萃取,CCl4层呈紫红色,Fe2+的还原性强于I- | |
| D. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
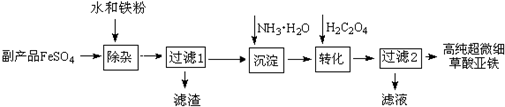
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com