
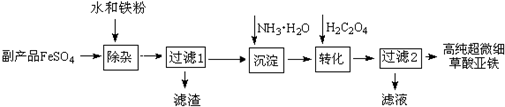
分析 副产品FeSO4(含TiO2+、Al3+)中加入水和铁粉,将少量重金属离子等除去,得到比较纯净的FeSO4溶液,向FeSO4溶液中加入氨水,生成氢氧化亚铁,氢氧化亚铁和草酸反应生成高纯超微细草酸亚铁沉淀,
(1)根据反应物和生成物写出化学方程式;Fe2+具有较强的还原性,Fe可以与氢离子反应调节pH;
(2)一水合氨水是弱碱不能拆,与亚铁离子生成氢氧化亚铁沉淀,据此书写离子反应方程式即可;
(3)氨水受热易分解,难溶性碱也具有热不稳定性,据此解答即可;
(4)氢氧化亚铁易被空气中氧气氧化;
(5)从溶液中得到晶体,需经过蒸发浓缩溶液、冷却结晶以及过滤洗涤等操作.
解答 解:(1)反应物为TiOSO4和H2O,已知产物为H2TiO3,根据原子守恒可知另一产物为硫酸,因此化学方程式为TiOSO4+2H2O=H2TiO3↓+H2SO4;由于Fe2+被具有很强的还原性,容易被氧化为Fe3+,铁粉的还原性比Fe2+强,因此可以防止Fe2+被氧化,另外Fe能与H+反应生成Fe2+,降低了氢离子的浓度,调节pH值,使Al3+水解完全生成Al(OH)3 沉淀,
故答案为:TiOSO4+2H2O=H2TiO3↓+H2SO4;与溶液中的H+反应,调节pH值,使Al3+水解完全生成Al(OH)3 沉淀;
(2)一水合氨是弱碱,与亚铁离子生成氢氧化亚铁沉淀,氨水不能拆,沉淀不能拆,故离子反应方程式为:2NH3•H2O+Fe2+=Fe(OH)2↓+2NH4+,
故答案为:2NH3•H2O+Fe2+=Fe(OH)2↓+2NH4+;
(3)氨水受热易分解生成氨气和水,氢氧化亚铁也具有热不稳定性,容易分解生成氧化物和水,故答案为:NH3•H2O和Fe(OH)2受热都易分解;
(4)在沉淀反应中产生的中间产物Fe(OH)2易被空气中氧气氧化,所以FeC2O4生成时,要在真空环境下进行,故答案为:氢氧化亚铁易被O2氧化;
(5)从溶液中得到晶体,需经过蒸发浓缩溶液、冷却结晶以及过滤、洗涤等操作,故答案为:冷却结晶、过滤、洗涤.
点评 本题考查氧化还原反应、离子除杂等相关知识,突出检验学生信息收集、整合、分析问题解决问题的能力,试题开放性强,有些答案不唯一,整体难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | 仅② | C. | ②④⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用粗盐代替NaCl固体 | |
| B. | 定容时,溶液液面低于容量瓶刻度线 | |
| C. | 从烧杯向容量瓶转移溶液时,有少量溶液溅出 | |
| D. | 向容量瓶转移溶液时,容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝比铁化学性质活泼 | |
| B. | 铝表面有一层致密氧化膜起保护作用 | |
| C. | 铝性质太活泼已经全部被氧化成了氧化铝 | |
| D. | 铁有可能只失去二个电子而铝失三个电子,从而比铝更容易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取7.68gCuSO4加水配成480mL溶液 | |
| B. | 称取12.5g 胆矾,加水配成500mL溶液 | |
| C. | 称取8.0CuSO4,加水500mL 溶解配成溶液 | |
| D. | 称取12.0g胆矾,加水480mL溶解配成溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com