
【题目】下列属于酸性氧化物的是( )
A. Na2O B. MgO C. H2O D. CO2
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】常见物质A~K之间存在如下图所示的转化关系,其中D、E为单质,请回答下列问题(图中有些反应的产物和反应的条件没有全部标出)。
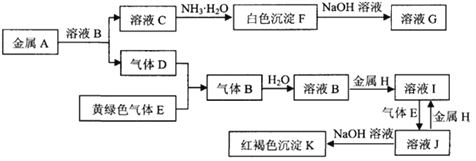
(1)写出下列物质中溶质的名称:B是 __________,G是____________
(2)反应“F→G”的化学方程式是_____________________________________________
(3)反应“J→I”的离子方程式是_____________________________________________
(4)溶液I中混有溶液J,除去J的方法是:________________________________________________________________
(5)检验溶液I中阳离子的方法是:__________________________
【答案】 氯化氢 偏铝酸钠 Al(OH)3+NaOH=NaAlO2+2H2O 2Fe3++Fe=3Fe2+ 加入足量的铁粉(过滤) 取少量溶液I于试管中,滴加几滴硫氰化钾溶液,溶液不变红色,再加几滴氯水,溶液变为红色,证明溶液中含有Fe2+。
【解析】C中加氨水生成白色沉淀F,F可溶于NaOH溶液中,可知F为Al(OH )3,则C中含有Al3+,从而A为Al。E为Cl2,D为气体且与Cl2反应生成另一种气体B,可推测B为HCl。验证可知B确为HCl。由红褐色沉淀K可知K为Fe(OH)3,所以H为Fe。
(1)由上面分析可知B是氯化氢、F为Al(OH )3,与NaOH反应生成Na2AlO2,G的名称为偏铝酸钠。
(2)Al(OH )3与NaOH反应生成Na2AlO2和H2O,化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O。
(3)金属H为Fe,B为HCl,所以I为FeCl2,J为 FeCl3,J→I的离子方程式为:2Fe3++Fe=3Fe2+。
(4)FeCl2溶液中混有FeCl3,可加入足量的Fe粉使Fe3+转化为Fe2+,然后过滤。
(5)检验FeCl2中Fe2+的方法:取少量溶液I于试管中,滴加几滴硫氰化钾溶液,溶液不变红色,再加几滴氯水,溶液变为红色,证明溶液中含有Fe2+。
【题型】推断题
【结束】
23
【题目】下图转化关系中,A、B、C、D、E都是短周期元素的单质,在常温常压下A是固体,其余都是气体,且C呈黄绿色。化台物H和I两种气体相遇时产生白烟。化合物G的焰色反应为黄色。反应①和②均在溶液中进行。
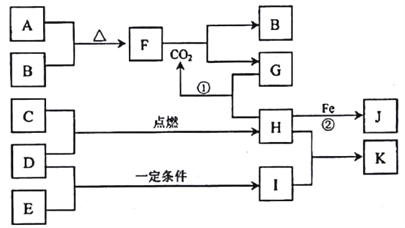
请按要求回答下列问题。
(l)写出下列物质的化学式:D________、F_______________。
(2)反应①的离子方程式为_____________。
(3)向K溶液中加入硝酸酸化的硝酸银溶液,反应的现象为__________。
(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色,该反应的离子方程式为_________。这说明单质C的氧化性_______于单质碘(填“强”或“弱”)。
(5)向J溶液中滴入NaOH溶液时,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由灰白色变成红褐色的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水硫酸铜是一种重要的化学试剂,工业上用低品位钢矿(合CuS、Cu2S、CuO,以及FeO、Fe2O3、SiO2等杂质)制备无水硫酸铜的流程如下图所示:
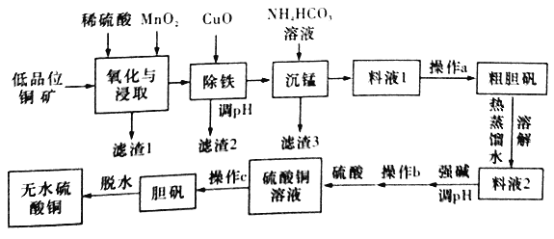
(NH4)2SO4、CuSO4的溶解度(g)部分数据如下表所示:
温度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
S(CuSO4)/g | 17 | 20.7 | 24.4 | 28.5 | 33.6 | 40 | 77 |
S[(NH4)SO4]/g | 73 | 75.4 | 78.1 | 81.0 | 84.5 | 87.8 | 102 |
(1)氧化与浸取过程中发生的反应之一为Cu2S被MnO2氧化时有一种非全属单质生成,则该反应的离子方程式为____________,滤渣1的主要成分是__________(填化学式),除铁时加入CuO能得到滤渣2的原理是__________________。
(2)除铁后,为了判断滤液中是否有Fe3+残留,请设计实验方案:__________。
(3)沉锰时还有一种酸性气体生成,则沉锰时发生反应的离子方程式为___________。(已知pH=8.8时,Mn2+开始沉淀)。
(4)为了从料液1中尽可能多地析出粗胆矾,操作a的内容是__________(填名称)。
(5)工业上利用上述原理制备胆矾。已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=8.0×10-38。离子浓度小于1×10-5mol/L时表明该离子已完全沉淀。常温下,若某溶液中c(Cu2+)=2.2 mol/L,c(Fe3+)=O.001mol/L,加入氧化铜除铁时,调节溶液pH范围为________(lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 用氯化铁溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+
B. Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-![]() =9Fe3++NO↑+14H2O
=9Fe3++NO↑+14H2O
C. 用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O
D. 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3+ + 2SO42- + 2Ba2+ + 4OH-== AlO2-+ 2BaSO4↓+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,加入少量氯化钠固体
D.将铝片改为铝粉,做铝与氧气反应的实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: 
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是、 .
(2)基态B原子的电子排布式为;B和N相比,电负性较大的是 , BN中B元素的化合价为 .
(3)在BF3分子中,F﹣B﹣F的键角是;B原子的杂化轨道类型为 , BF3与过量NaF作用可生成NaBF4 , B的立体构型为 .
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm.立方氮化硼晶胞中含有个氮原子、个硼原子,立方氮化硼的密度是gcm﹣3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)“酸溶”时,Fe2O3与硫酸反应的化学方程式为____。
(2)滤渣I的主要成分是FeS2、S和______(填化学式);Fe3+被FeS2还原的离子方程式为______。
(3)“氧化”中,生成FeOOH的离子方程式为_______________。
(4)滤液II中溶质是Al2(SO4)3和______(填化学式):“洗涤”时,检验铁黄表而已洗涤干净的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 LCO和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ④⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com