
【题目】氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: 
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是、 .
(2)基态B原子的电子排布式为;B和N相比,电负性较大的是 , BN中B元素的化合价为 .
(3)在BF3分子中,F﹣B﹣F的键角是;B原子的杂化轨道类型为 , BF3与过量NaF作用可生成NaBF4 , B的立体构型为 .
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm.立方氮化硼晶胞中含有个氮原子、个硼原子,立方氮化硼的密度是gcm﹣3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
【答案】
(1)B2O3+3CaF2+3H2SO4 ![]() 2BF3↑+3CaSO4+3H2O;B2O3+2NH3
2BF3↑+3CaSO4+3H2O;B2O3+2NH3 ![]() 2BN+3H2O
2BN+3H2O
(2)1s22s2sp1;N;+3
(3)120°;sp2;正四面体
(4)4;4;![]()
【解析】解:(1)由图可知B2O3与CaF2和H2SO4反应即生成BF3 , 同时还应该产生硫酸钙和水,方程式为B2O3+3CaF2+3H2SO4 ![]() 2BF3↑+3CaSO4+3H2O;B2O3与氨气在高温下反应即生成BN,方程式为B2O3+2NH3
2BF3↑+3CaSO4+3H2O;B2O3与氨气在高温下反应即生成BN,方程式为B2O3+2NH3 ![]() 2BN+3H2O, 故答案为:B2O3+3CaF2+3H2SO4
2BN+3H2O, 故答案为:B2O3+3CaF2+3H2SO4 ![]() 2BF3↑+3CaSO4+3H2O;B2O3+2NH3
2BF3↑+3CaSO4+3H2O;B2O3+2NH3 ![]() 2BN+3H2O;(2)基态B原子的电子排布式为1s22s2sp1;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3.故答案为:1s22s2sp1;N;+3;(3)依据价层电子对互斥理论,计算出BF3的孤对电子对数=
2BN+3H2O;(2)基态B原子的电子排布式为1s22s2sp1;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3.故答案为:1s22s2sp1;N;+3;(3)依据价层电子对互斥理论,计算出BF3的孤对电子对数= ![]() ×(a﹣xb)=
×(a﹣xb)= ![]() ×(3﹣3×1)=0,并且价层电子对数为3,所以BF3分子为平面正三角形结构,键角为120°,杂化方式为sp2;BF4﹣中心原子的孤对电子对数=
×(3﹣3×1)=0,并且价层电子对数为3,所以BF3分子为平面正三角形结构,键角为120°,杂化方式为sp2;BF4﹣中心原子的孤对电子对数= ![]() ×(a﹣xb)=
×(a﹣xb)= ![]() ×(4﹣4×1)=0,其价层电子对数为4,所以其结构为正四面体.故答案为:120°;sp2;正四面体;(4)根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数=8×
×(4﹣4×1)=0,其价层电子对数为4,所以其结构为正四面体.故答案为:120°;sp2;正四面体;(4)根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数=8× ![]() +6×
+6× ![]() +4=8,因此一个立方氮化硼晶胞中含有4个N原子和4个B原子.一个晶胞中的质量为
+4=8,因此一个立方氮化硼晶胞中含有4个N原子和4个B原子.一个晶胞中的质量为 ![]() ,一个立方氮化硼晶胞的体积是(361.5pm)3 , 因此立方氮化硼的密度
,一个立方氮化硼晶胞的体积是(361.5pm)3 , 因此立方氮化硼的密度 ![]() 是 gpm﹣3 .
是 gpm﹣3 .
故答案为:4;4; ![]() .
.
(1)由图及元素守恒可写出这两个反应的方程式:B2O3+3CaF2+3H2SO4 ![]() 2BF3↑+3CaSO4+3H2O;B2O3+2NH3
2BF3↑+3CaSO4+3H2O;B2O3+2NH3 ![]() 2BN+3H2O;(2)B的原子序数为5,其基态原子的电子排布式为1s22s22p1;B和N都属于第二周期元素,同周期自左至右元素的电负性逐渐增大,故电负性较大的是N;B属于第ⅢA族元素,化合价为+3价.(3)依据价层电子对互斥理论,计算出的孤对电子对数以及价层电子对数,可判断出分子的空间构型;(4)描述晶体结构的基本单元叫做晶胞,金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,如图所示:
2BN+3H2O;(2)B的原子序数为5,其基态原子的电子排布式为1s22s22p1;B和N都属于第二周期元素,同周期自左至右元素的电负性逐渐增大,故电负性较大的是N;B属于第ⅢA族元素,化合价为+3价.(3)依据价层电子对互斥理论,计算出的孤对电子对数以及价层电子对数,可判断出分子的空间构型;(4)描述晶体结构的基本单元叫做晶胞,金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,如图所示:  所以金刚石的一个晶胞中含有的碳原子数=8×
所以金刚石的一个晶胞中含有的碳原子数=8× ![]() +6×
+6× ![]() +4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为
+4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为 ![]() ,一个立方氮化硼晶胞的体积是(361.5pm)3 , 因此立方氮化硼的密度是
,一个立方氮化硼晶胞的体积是(361.5pm)3 , 因此立方氮化硼的密度是 ![]() gpm﹣3 .
gpm﹣3 .


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究。

已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO + PdCl2 + H2O = CO2 + 2HCl + Pd↓
(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是_ 。
(2)装置B的作用是_ 。
(3)装置C、D中所盛试剂分别为_ ___ 、_ ___,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为_ 。
(4)该装置的缺点是_ 。
(5)资料表明,上述反应在焦炭过量时会生成副产物SiC。取18 g SiO2和8.4 g焦炭充分反应后收集到标准状况下的气体13.44 L,假定气体产物只有CO,固体产物只有Si和SiC,则Si和SiC的物质的量之比为_ 。
(6)设计实验证明碳酸的酸性比硅酸的强:_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是无色有刺激性气味的液体,熔点为-54.1℃,沸点为69℃,在潮湿空气中易“发烟”。实验室利用SO2(g)和Cl2(g)合成硫酰氯的实验装置如下图所示(部分夹持装置已省略):
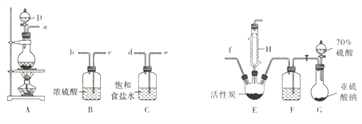
回答下列问题:
(1)实验室制备干燥纯净的氯气可以用A、B、C装置来完成,请连接装置接口:a→___,____→___,______→f(按气流流动方尚;用小写学母表示)。
(2)实验过程中,使用分液漏斗滴加浓硫酸的操作是_____________。
(3)装置C的作用是____________;装置B和F中浓硫酸起到的作用是①____________;②可观察到____________(填现象)来反映通入气体的速率,利用反应液滴加的快慢对气体通入速率加以控制,从而使通入反应器的SO2和Cl2达到最佳反应比例。
(4)该装置存在明显的缺陷,请指出:________________。
(5)已知该法合成硫酰氯为可逆反应,每生成2.7g硫酰氯放出热量1940J,写出该反应的热化学方程式: ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体),下列分析或结果错误的是
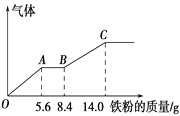
A. 原混合酸中HNO3的物质的量为0.1 mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+ == 3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
A. 以Y浓度变化表示的反应速率为0.0005 mol/(L·s)
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2
C. 其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
D. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
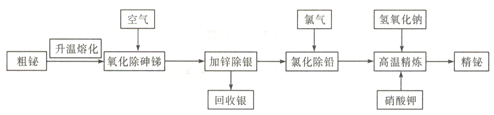
【题目】铋是一种绿色稀有金属,铋及其化合物在工业生产中用途广泛,工业上常采用粗铋精炼制得用途更为广泛的精炼铋(含铋99.995%),火法精炼铋的工艺流程如下:
已知:①粗铋(铅铋合金)的主要化学成分如下表:
元素 | Ag | Bi | Pb | As | Sb |
含量/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
②氯化铅熔点为498℃,密度为5.9g/cm3;铋的熔点为271℃,沸点为1470℃;BiCl3的熔点为506.5℃。
③锌酸盐简写成ZnO22-,如锌酸钠Na2ZnO2。
④+3价铋的化合物较为稳定,铋酸钠难溶于水。
回答下列问题:
(1)实验室中升温熔化粗铋一般用酒精喷灯在________(填主要仪器名称)中完成。
(2)NaBiO3中铋元素的化合价为________。
(3)“氧化除砷锑”的工艺机理是粗铋熔融液在680~750℃的条件下,鼓入压缩空气,使砷、锑氧化挥发,同时空气也与铋液反应,利用Bi2O3的_______性将杂质砷、锑转变成As2O3、Sb2O3而除去。
(4)“氯化除铅”过程中,氯气与铅、铋反应分别生成PbCl2、BiCl3,生成的BiCl3又会被铅还原,发生反应3Pb+2BiCl3=3PbC12+2Bi,控制温度350-400℃,利用熔点和密度特点,氯化铅上浮至铋液表面呈_______态覆盖,防止氯气__________________。
(5)高温精炼的实质为碱性精炼,加入少量KNO3和NaOH,将锌氧化成锌酸盐而除去残锌,同时得到氮气,写出高温精炼的化学方程式: __________________。
(6)向含有MnSO4的酸性溶液中加入铋酸钠粉末,溶液变为紫红色,该反应经常用来检验Mn2+,写出该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物能用溶解、过滤、蒸发三步操作分离的是( )
A. 水和酒精的混合物
B. 氯化钠固体和硝酸钾固体的混合物
C. 氯化钾固体和氯化银固体的混合物
D. 硫酸钡固体和碳酸钡固体的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com