
【题目】硫酰氯(SO2Cl2)是无色有刺激性气味的液体,熔点为-54.1℃,沸点为69℃,在潮湿空气中易“发烟”。实验室利用SO2(g)和Cl2(g)合成硫酰氯的实验装置如下图所示(部分夹持装置已省略):
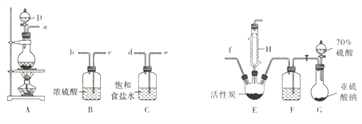
回答下列问题:
(1)实验室制备干燥纯净的氯气可以用A、B、C装置来完成,请连接装置接口:a→___,____→___,______→f(按气流流动方尚;用小写学母表示)。
(2)实验过程中,使用分液漏斗滴加浓硫酸的操作是_____________。
(3)装置C的作用是____________;装置B和F中浓硫酸起到的作用是①____________;②可观察到____________(填现象)来反映通入气体的速率,利用反应液滴加的快慢对气体通入速率加以控制,从而使通入反应器的SO2和Cl2达到最佳反应比例。
(4)该装置存在明显的缺陷,请指出:________________。
(5)已知该法合成硫酰氯为可逆反应,每生成2.7g硫酰氯放出热量1940J,写出该反应的热化学方程式: ________________。
【答案】 e d c b 打开分液漏斗上口玻璃塞(或使塞上凹槽对准容器上小孔),旋动活塞,使塞上小孔对准漏斗颈方向 除去氯气中的HCl杂质 干燥气体 装置B和F中产生气泡的快慢 末端没有尾气处理装置和干燥装置,易污染大气,外界水蒸气易进入装置内 SO2(g)+Cl2(g)![]() SO2Cl2(1) △H=-97kJ/mol
SO2Cl2(1) △H=-97kJ/mol
【解析】(1)实验室制备干燥纯净的氯气可以用A、B、C装置来完成,A为反应装置,B为干燥装置,C为除杂装置,除去氯气中的氯化氢气体,故连接装置顺序为接口:a→e,d→c,b→f;(2)实验过程中,使用分液漏斗滴加浓硫酸的操作是打开分液漏斗上口玻璃塞(或使塞上凹槽对准容器上小孔),旋动活塞,使塞上小孔对准漏斗颈方向;(3)盐酸易挥发,加热条件下制取得到的氯气中含有氯化氢,装置C的作用是除去氯气中的HCl杂质;装置B和F中浓硫酸起到的作用是①干燥气体,以免制得的硫酰氯“发烟”;②可观察到装置B和F中产生气泡的快慢来反映通入气体的速率,利用反应液滴加的快慢对气体通入速率加以控制,从而使通入反应器的SO2和Cl2达到最佳反应比例;(4)该装置存在明显的缺陷:末端没有尾气处理装置和干燥装置,易污染大气,外界水蒸气易进入装置内;(5)2.7g硫酰氯的物质的量为![]() 0.02mol,放出热量1940J,则生成1mol硫酰氯的焓变为-
0.02mol,放出热量1940J,则生成1mol硫酰氯的焓变为-![]() =-97kJ/mol,该反应的热化学方程式为:SO2(g)+Cl2(g)
=-97kJ/mol,该反应的热化学方程式为:SO2(g)+Cl2(g)![]() SO2Cl2(1) △H=-97kJ/mol。
SO2Cl2(1) △H=-97kJ/mol。


科目:高中化学 来源: 题型:
【题目】Se是人体必需微量元素,下列有关 ![]() Se和
Se和 ![]() Se的说法正确的是( )
Se的说法正确的是( )
A.![]() ?Se 和
?Se 和 ![]() Se所含电子数不同
Se所含电子数不同
B.![]() Se和
Se和 ![]() Se都含有34个中子
Se都含有34个中子
C.![]() Se和
Se和 ![]() Se分别含有44和46个质
Se分别含有44和46个质
D.![]() Se和
Se和 ![]() Se互为同位素
Se互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图像部分重叠)溶液中离子的对应关系,正确的是
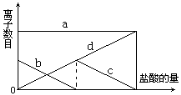
A.a:Cl- b:K+ c:CO32- d:HCO3-
B.a:K+ b:CO32- c:Cl- d:HCO3-
C.a:K+ b:CO32- c:HCO3- d:Cl-
D.a:K+ b:HCO3- c:Cl- d:CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水硫酸铜是一种重要的化学试剂,工业上用低品位钢矿(合CuS、Cu2S、CuO,以及FeO、Fe2O3、SiO2等杂质)制备无水硫酸铜的流程如下图所示:
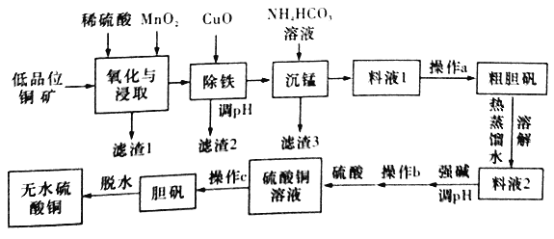
(NH4)2SO4、CuSO4的溶解度(g)部分数据如下表所示:
温度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
S(CuSO4)/g | 17 | 20.7 | 24.4 | 28.5 | 33.6 | 40 | 77 |
S[(NH4)SO4]/g | 73 | 75.4 | 78.1 | 81.0 | 84.5 | 87.8 | 102 |
(1)氧化与浸取过程中发生的反应之一为Cu2S被MnO2氧化时有一种非全属单质生成,则该反应的离子方程式为____________,滤渣1的主要成分是__________(填化学式),除铁时加入CuO能得到滤渣2的原理是__________________。
(2)除铁后,为了判断滤液中是否有Fe3+残留,请设计实验方案:__________。
(3)沉锰时还有一种酸性气体生成,则沉锰时发生反应的离子方程式为___________。(已知pH=8.8时,Mn2+开始沉淀)。
(4)为了从料液1中尽可能多地析出粗胆矾,操作a的内容是__________(填名称)。
(5)工业上利用上述原理制备胆矾。已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=8.0×10-38。离子浓度小于1×10-5mol/L时表明该离子已完全沉淀。常温下,若某溶液中c(Cu2+)=2.2 mol/L,c(Fe3+)=O.001mol/L,加入氧化铜除铁时,调节溶液pH范围为________(lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,图1表示白磷(P4)的分子结构,图2表示三氧化二磷(P4O6)的分子结构,图3表示五氧化二磷(P4O10)的分子结构,下列说法中正确的是( ) 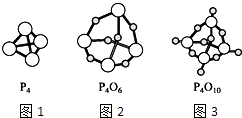
A.P4O6中的磷原子采用sp2方式杂化
B.三氧化二磷、五氧化二磷这两个名称都表示分子的实际组成
C.P4、P4O6和P4O10分子中同一P原子上两个化学键之间的夹角都是60°
D.P4O6分子中4个P原子构成正四面体,6个O原子构成正八面体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 用氯化铁溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+
B. Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-![]() =9Fe3++NO↑+14H2O
=9Fe3++NO↑+14H2O
C. 用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O
D. 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3+ + 2SO42- + 2Ba2+ + 4OH-== AlO2-+ 2BaSO4↓+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: 
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是、 .
(2)基态B原子的电子排布式为;B和N相比,电负性较大的是 , BN中B元素的化合价为 .
(3)在BF3分子中,F﹣B﹣F的键角是;B原子的杂化轨道类型为 , BF3与过量NaF作用可生成NaBF4 , B的立体构型为 .
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm.立方氮化硼晶胞中含有个氮原子、个硼原子,立方氮化硼的密度是gcm﹣3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,13g某气体所含的分子数与14gCO 所含的分子数相等。此气体在标准状况下的密度为( )
A. 1.25g·L-1 B. 2.32 g·L-1 C. 1.65 g·L-1 D. 1.16 g·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com