
【题目】赏心悦目的雕花玻璃是用一种物质对玻璃进行刻蚀而制成的,这种物质是( )
A.硫酸
B.烧碱
C.盐酸
D.氢氟酸
科目:高中化学 来源: 题型:
【题目】有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加足最NaOH溶液加热后,收集到气体0.04 mol;(3)第三份加足量BaCl2溶液后,干燥后得到沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,下列推测正确的是
①K+一定存在;②100mL溶液中含0.01molCO32-;③Cl-可能存在;④ Ba2+一定不存在;⑤Mg2+可能存在
A. ②③④ B. ③④⑤ C. ①②③ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:
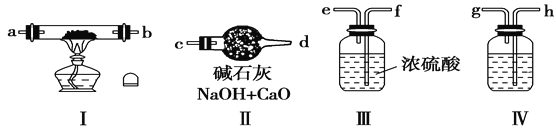
请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→________→________→________(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是___________,其作用是____________________。
(3)装置Ⅱ的作用是_________________________________________。
(4)加热装置Ⅰ时发生反应的化学方程式为___________________________。
(5)下列对于过氧化钠的叙述中,正确的是___________。
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,在浓度为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:① 2Fe3++H2O2 == 2Fe2++O2↑+2H+,② H2O2+2Fe2++2H+ == 2H2O+2Fe3+。反应过程中能量变化如下图所示。下列说法错误的是
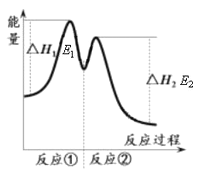
A. Fe3+的作用是增大过氧化氢的分解速率
B. 反应①是吸热反应、反应②是放热反应
C. 反应2H2O2(aq) == 2H2O(l)+O2(g)的ΔH=E1-E2<0
D. 0~6 min的平均反应速率:v(H2O2)=3.33×10-2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子个数之比为________;氧原子个数之比为____________;相同条件下体积之比为________。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92 g 该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。RO2的化学式为______。
(3)常温下,在27.5 g水中溶解12.5 g CuSO4·5H2O,恰好达到饱和,该溶液的密度为1.60 g/cm3,则该溶液中CuSO4的物质的量浓度为____________,从中取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究。

已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO + PdCl2 + H2O = CO2 + 2HCl + Pd↓
(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是_ 。
(2)装置B的作用是_ 。
(3)装置C、D中所盛试剂分别为_ ___ 、_ ___,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为_ 。
(4)该装置的缺点是_ 。
(5)资料表明,上述反应在焦炭过量时会生成副产物SiC。取18 g SiO2和8.4 g焦炭充分反应后收集到标准状况下的气体13.44 L,假定气体产物只有CO,固体产物只有Si和SiC,则Si和SiC的物质的量之比为_ 。
(6)设计实验证明碳酸的酸性比硅酸的强:_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是无色有刺激性气味的液体,熔点为-54.1℃,沸点为69℃,在潮湿空气中易“发烟”。实验室利用SO2(g)和Cl2(g)合成硫酰氯的实验装置如下图所示(部分夹持装置已省略):
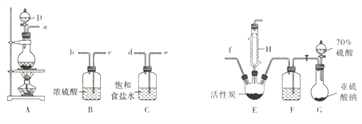
回答下列问题:
(1)实验室制备干燥纯净的氯气可以用A、B、C装置来完成,请连接装置接口:a→___,____→___,______→f(按气流流动方尚;用小写学母表示)。
(2)实验过程中,使用分液漏斗滴加浓硫酸的操作是_____________。
(3)装置C的作用是____________;装置B和F中浓硫酸起到的作用是①____________;②可观察到____________(填现象)来反映通入气体的速率,利用反应液滴加的快慢对气体通入速率加以控制,从而使通入反应器的SO2和Cl2达到最佳反应比例。
(4)该装置存在明显的缺陷,请指出:________________。
(5)已知该法合成硫酰氯为可逆反应,每生成2.7g硫酰氯放出热量1940J,写出该反应的热化学方程式: ________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com