
【题目】有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加足最NaOH溶液加热后,收集到气体0.04 mol;(3)第三份加足量BaCl2溶液后,干燥后得到沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,下列推测正确的是
①K+一定存在;②100mL溶液中含0.01molCO32-;③Cl-可能存在;④ Ba2+一定不存在;⑤Mg2+可能存在
A. ②③④ B. ③④⑤ C. ①②③ D. ①③④
【答案】D
【解析】第一份:第一份加入AgNO3,溶液有沉淀产生,说明溶液中可能存在:Cl-、CO32-、SO42-;第二份:加足量NaOH溶液加热后生成氨气0.04mol,则溶液中一定含有NH4+;第三份:根据题中信息可知2.33为硫酸钡,n(BaSO4)=n(SO42-)=![]() =0.01mol;6.27g为硫酸钡和碳酸钡,所以碳酸钡的物质的量为:
=0.01mol;6.27g为硫酸钡和碳酸钡,所以碳酸钡的物质的量为: ![]() =0.02mol;因为一定含CO32-所以不含Mg2+;再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;n(-)=2n(CO32-)+2n(SO42-)=0.06mol,故一定有K+,至少0.02mol;①K+一定存在,故正确;②100mL溶液中含0.02molCO32-,故错误;③因含有CO32-、SO42-,故实验过程中无法对Cl-的检验进行确定,无法确定是否含有Cl-,Cl-可能存在,故正确;④ Ba2+一定不存在,故正确;⑤Mg2+一定不存在,故错误。答案选D。
=0.02mol;因为一定含CO32-所以不含Mg2+;再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;n(-)=2n(CO32-)+2n(SO42-)=0.06mol,故一定有K+,至少0.02mol;①K+一定存在,故正确;②100mL溶液中含0.02molCO32-,故错误;③因含有CO32-、SO42-,故实验过程中无法对Cl-的检验进行确定,无法确定是否含有Cl-,Cl-可能存在,故正确;④ Ba2+一定不存在,故正确;⑤Mg2+一定不存在,故错误。答案选D。


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液 体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
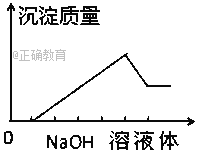
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
【答案】B
【解析】根据图像,可以看出分为4个阶段:第一阶段无沉淀,第二阶段沉淀量逐渐增多到最大量,第三阶段有部分沉淀能和氢氧化钠继续反应,即部分沉淀溶解,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加。第一阶段无沉淀,说明水溶液中一定含有氢离子,故AD错误,第三阶段有部分沉淀能和氢氧化钠继续反应,说明部分沉淀是氢氧化铝,原溶液中一定含有铝离子,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加,说明一定有一种沉淀和氢氧化钠不反应,可推知该沉淀是氢氧化镁,原溶液中一定含有镁离子,铜离子有颜色,与溶液无色不符,故B正确,C错误;故选B。
【题型】单选题
【结束】
14
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由FeO、Fe3O4和Fe2O3组成的混合物,测得其中铁元素与氧元素的质量比为21:8,则该混合物中FeO、Fe3O4和Fe2O3的物质的量之比可能是
A. 1:2:1 B. 2:1:1 C. 1:2:2 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪.制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了.“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是( )
A.硫的还原性
B.硫的漂白性
C.二氧化硫的还原性
D.二氧化硫的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
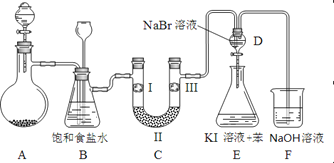
(1)制备氯气选用的药品为:漂粉精固体【主要成分为Ca(ClO)2】和浓盐酸,相关的化学反应方程式为:______________________________________________。
(2)装置B中饱和食盐水的作用是____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象_______________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入:________。
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是____________________________。该现象_______(填“能”或“不能”)说明溴的氧化性强于碘,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=l.84g·cm-3)配制240mLl.84mol.L-1稀硫酸,下列操作正确的是 ( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100mL量筒、250mL容量瓶和托盘天平
C. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
D. 量取浓硫酸的体积为25.0mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的__________周期_________族。下面有关硅材料的说法中正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰
E. 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(2)工业上用石英砂和焦炭可制得粗硅。
已知:

请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g) △H=_____________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:________________________________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用_________________方法提纯SiHCl3。
物质 | SiHCl3 | SiCl4 | AsCl3 |
沸点/℃ | 32.0 | 57.5 | 131.6 |
②用SiHCl3制备高纯硅的反应为SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是_____________________(填字母序号)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是_____________________(填字母序号)。
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是![]()
C.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HC1和另一种物质,写出配平的化学反应方程式:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com