
【题目】下列有关材料的说法错误的是
A.大理石的主要成分是碳酸钙B.海边的铁制品比较容易生锈
C.光导纤维的主要成分是硅D.铝合金质轻、抗腐蚀性强
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪.制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了.“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是( )
A.硫的还原性
B.硫的漂白性
C.二氧化硫的还原性
D.二氧化硫的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的__________周期_________族。下面有关硅材料的说法中正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰
E. 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(2)工业上用石英砂和焦炭可制得粗硅。
已知:

请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g) △H=_____________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:________________________________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用_________________方法提纯SiHCl3。
物质 | SiHCl3 | SiCl4 | AsCl3 |
沸点/℃ | 32.0 | 57.5 | 131.6 |
②用SiHCl3制备高纯硅的反应为SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是_____________________(填字母序号)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是_____________________(填字母序号)。
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是![]()
C.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HC1和另一种物质,写出配平的化学反应方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 硫酸与氢氧化钡溶液反应:H++ OH-= H2O
B. 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++ 3H2↑
C. 氯气通入水中:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D. AlCl3溶液中加入足量的氨水:Al3++ 3NH3·H2O = Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式正确的是
A. 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3===Ca2++2CH3COO-+CO2↑+H2O
B. NaOH溶液中通入Cl2 :2Cl2 + 2OH- = 3Cl- + ClO- + H2O
C. 稀硫酸中加入铁粉 2Fe+6H+===2Fe3++3H2↑
D. Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO+2OH-===CaCO3↓+CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.试回答下列问题: 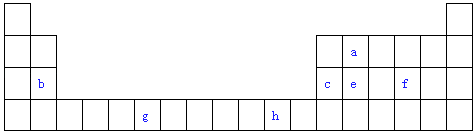
(1)写出元素g的基态原子电子排布式 .
(2)f在空气中燃烧产物的分子构型为 , 中心原子的杂化形式为 , 该分子是(选填“极性”、“非极性”)分子.
(3)由a原子跟e原子以1:1相互交替结合而形成的晶体,晶型与晶体e相同.两者相比熔点更高的是(填化学式),试从结构角度加以解释 .
(4)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 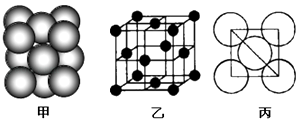
若已知c的原子半径为d厘米,NA代表阿伏伽德罗常数,c的相对原子质量为M,请回答:
①晶胞中c原子的配位数为 , 表示原子空间占有率的代数式为 .
②该晶体的密度为g/cm3(用含有关字母的代数式表示),b、h中,与c单质晶体中原子的堆积方式相同的是(填元素符号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铝合金8.3g溶于300mL2mol/L盐酸时,在标准状况下产生气体5.6L。若向反应后的溶液中加入适量烧碱溶液,充分搅拌,生成沉淀的最大质量为
A. 9g B. 16.8g C. 18.5g D. 22.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图像部分重叠)溶液中离子的对应关系,正确的是
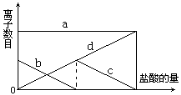
A.a:Cl- b:K+ c:CO32- d:HCO3-
B.a:K+ b:CO32- c:Cl- d:HCO3-
C.a:K+ b:CO32- c:HCO3- d:Cl-
D.a:K+ b:HCO3- c:Cl- d:CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com