
| a |
| 3 |
| b |
| 3 |
| 3 |
| 4 |
| 3 |
| 4 |
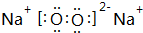 ,
, ;
;| b |
| 3 |
| a |
| 3 |
| a |
| 3 |
| a |
| 3 |
| b |
| 3 |


科目:高中化学 来源: 题型:
 (1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:下列各项中,不能够说明该反应已达到平衡的是
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:下列各项中,不能够说明该反应已达到平衡的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A>C>B |
| B、A>B>C |
| C、B>A>C |
| D、B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一个M的分子中有38个电子 |
| B、M中一定含有醛基和羧基 |
| C、M不存在链状的同分异构体 |
D、M的结构式为  |
查看答案和解析>>
科目:高中化学 来源: 题型:
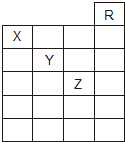 如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )| A、只有③ | B、只有①④ |
| C、只有①②③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴 | 若溶液褪色 | 假设1成立 |
| 若溶液不褪色 | 假设1或2成立 | ||
| ② | 向b试管中滴加几滴 | 若溶液褪色 | 假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向c试管中滴加几滴 | | 假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素A | 元素B | 元素C | 元素X | 元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中σ键与π数目比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com