
| A、一个M的分子中有38个电子 |
| B、M中一定含有醛基和羧基 |
| C、M不存在链状的同分异构体 |
D、M的结构式为  |
 和
和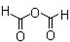 ,故D错误;
,故D错误;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、原子半径:W>Z |
| B、最高价氧化物的水化物的酸性:R>W |
| C、气态氢化物的稳定性:X>W |
| D、单质与水(或酸)反应的剧烈程度:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钾与水反应的离子方程式:K+H2O═K++OH-+H2↑ |
| B、向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH -=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“类钫”在化合物中是+1价 |
| B、“类钫”具有放射性 |
| C、“类钫”单质的密度大于l g?cm-3 |
| D、“类钫”单质有较高的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| 3 |
| b |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 化学式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com