
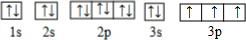 ,故答案为:
,故答案为: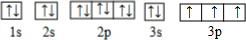 ;
;
| ||
| ||


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
| A、一个M的分子中有38个电子 |
| B、M中一定含有醛基和羧基 |
| C、M不存在链状的同分异构体 |
D、M的结构式为  |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F 六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,C元素原子的最外层电子数是其内层电子数的3倍,D元素的主族序数等于其周期数,E元素原子的最外层电子数是其电子层数的2倍,G单质是日常生活中用量最大的金属,易被腐蚀,试回答下列问题:
A、B、C、D、E、F 六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,C元素原子的最外层电子数是其内层电子数的3倍,D元素的主族序数等于其周期数,E元素原子的最外层电子数是其电子层数的2倍,G单质是日常生活中用量最大的金属,易被腐蚀,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了保护水资源,禁止使用化肥 |
| B、用电解大量水的方法获得清洁能源氧气 |
| C、4℃时,纯水的pH=7 |
| D、城市浇花,采用喷灌、滴滴灌技术 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气的水溶液可以导电,氯气是电解质 |
| B、在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+ )增大 |
| C、升高温度,可逆反应的化学平衡常数一定增大 |
| D、在 CH3COONa 溶液中加入适量 CH3COOH,可使 c( Na+)=c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com