
【题目】某兴趣小组为深度学习“二氧化硫的性质“,设计了如下系列实验:
(1)用图1装置制取并收集SO2以验证其氧化性 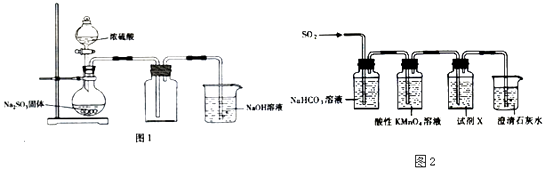 ①实验时为控制SO2产牛的快慢.应采取的措施是;
①实验时为控制SO2产牛的快慢.应采取的措施是;
②烧杯中NaOH溶液的作用是;
③将燃着的Mg条迅速插人集满SO2的集气瓶中,发现Mg条继续燃烧,则反应后生成的含硫物质可能是(填化学式,写出一种即可).
(2)用图2装置验证H2SO3比H2CO3的酸性强 ④酸性KMn04溶液可以吸收S02 , 将其氧化而除去,自身被还原为Mn2+ , 写出该反应的离子方程式;
⑤试剂X是;
⑥当观察到 , 即证明H2SO3比H2CO3酸性强.
【答案】
(1)控制滴浓硫酸的速度;吸收SO2气体,防止污染环境;S、MgS
(2)5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+;品红溶液;品红溶液不褪色,澄清石灰水变浑浊
【解析】解:(1)根据装置图可知,实验中用亚硫酸钠与浓硫酸反应制二氧化硫,用向上排空气法收集,用氢氧化钠溶液吸收二氧化硫尾气,①实验时为控制SO2产生的快慢,可以控制滴浓硫酸的速度,所以答案是:控制滴浓硫酸的速度;②二氧化硫有毒,会污染空气,所以要进行尾气吸收,所以烧杯中NaOH溶液的作用是吸收SO2气体,防止污染环境,
所以答案是:吸收SO2气体,防止污染环境;③将燃着的Mg条迅速插入集满SO2的集气瓶中,发现Mg条继续燃烧,发生氧化还原反应,硫的化合价降低,根据化合价升降推测可知,反应后生成的含硫物质可能是S、MgS、MgS和S、S和MgSO3 ,
所以答案是:S、MgS;(2)验证H2SO3比H2CO3酸性强,可以用亚酸与碳酸盐反应生成二氧化碳即可,所以将二氧化硫通入碳酸钠溶液中,用高锰酸钾溶液除去混合气体中的二氧化硫,用品红溶液检验二氧化硫是否除尽,除去二氧化硫后如果澄清石灰水变浑,则说明有二氧化碳产生,即可证明H2SO3比H2CO3酸性强.④二氧化硫具有还原性和KMnO4在水溶液中发生氧化还原反应,生成硫酸和硫酸锰,依据氧化还原反应电子守恒和原子守恒配平得到,5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+;
所以答案是:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+;⑤根据上面的分析可知,试剂X是 品红溶液,其作用是 检验SO2是否除尽,
所以答案是:品红溶液;⑥当观察到 品红溶液不褪色,说明SO2已经除尽,澄清石灰水变浑浊,即证明H2SO3比H2CO3酸性强,
所以答案是:品红溶液不褪色,澄清石灰水变浑浊.


科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为 2NO2(g,红棕色)+O3(g) ![]() N2O5(g,无色)+O2(g)。下列有关说法正确的是
N2O5(g,无色)+O2(g)。下列有关说法正确的是
A. 达到平衡时v正(NO2)∶v逆(N2O5)=1∶2
B. 达到平衡时,c(NO2)∶c(O3)∶c(N2O5)=2∶1∶1
C. 达到平衡时,v正=v逆=0
D. 达到平衡时,混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 油脂能在碱性条件下水解,可用于工业上制取肥皂
B. 碘单质易溶于有机溶剂,可用酒精萃取碘水中的碘
C. 二氧化锰具有较强的氧化性,可用于H2O2分解的氧化剂
D. 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH(C2H5)CH(CH3)2的名称是( )
A.1,3﹣二甲基戊烷
B.2﹣甲基﹣3﹣乙基丁烷
C.3,4﹣二甲基戊烷
D.2,3﹣二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是生命的摇篮,有关海洋中部分资源的利用如图所示,回答下列问题 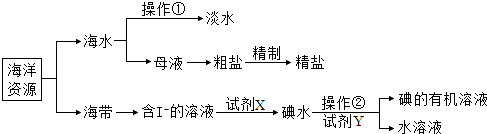
(1)操作①是 , 操作②使用的主要玻璃仪器是;
(2)含I﹣溶液中加入试剂X的目的是将I﹣(填“氧化”或“还原”)成I2;试剂Y选择原则包括:与碘不反应、碘在Y中的溶解度大于在水中的溶解度和;
(3)为除去粗盐中含有硫酸钠、氯化镁、氯化钙等杂质,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质,将杂质转化为沉淀过滤除去,再向滤液中加入适量盐酸得到精盐水.该工程示意如下: 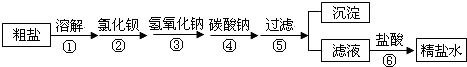
以下叙述正确的是(双选)
A.①操作中需要进行搅拌,目的是提高氯化钠的溶解度
B.③、④两步操作顺序可以颠倒
C.⑤操作得的沉淀中共有三种物质
D.⑥操作中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
(4)海水资源也可以提炼出铝,铝制品与铁制品相比,在空气中不易锈蚀,原因是:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下可以转化的是( )
A.CaCl2 ![]() CaCO3
CaCO3 ![]() CaO
CaO
B.Fe ![]() FeCl2
FeCl2 ![]() Fe(OH)2
Fe(OH)2
C.Al2O3 ![]() NaAlO2
NaAlO2 ![]() Al(OH)3
Al(OH)3
D.SiO2 ![]() H2SiO3
H2SiO3 ![]() Na2SiO3
Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式的反应热表示可燃物的燃烧热的是
A. H2(g)+I2(g)![]() 2HI(g) △H=-9.48 kJ mol-1
2HI(g) △H=-9.48 kJ mol-1
B. CH4(g)+2O2(g)=2H2O(g)+CO2(g) △H =-802.3 kJ mol-1
C. 2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ mol-1
D. H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8 kJ mol-1
O2(g)=H2O(l) △H=-285.8 kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,相同体积的CO和C2H4的比较中正确的是( ) ①所含的分子数目之比为1:1 ②所含的质子数目之比为1:1
③所含的原子总数目之比为1:3 ④两者的密度之比为:1:1.
A.①②③④
B.①②④
C.②③④
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现应用酸碱中和滴定法测定某市售白醋的含酸量.
Ⅰ.实验步骤
(1)用___________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_________作指示剂.
(3)读取盛装0.1000 molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如右图所示,则此时的读数为_______mL.
![]()
(4)滴定.滴定过程中,眼睛应注视__________________________; 当滴至____________________________________时停止滴定,并记录NaOH溶液的终读数.重复滴定4次.
Ⅱ.实验记录
实验序号 | 待测白醋溶液体积/mL | 0.1000mol·L-1 NaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 0.10 | 15.10 |
2 | 20.00 | 0.00 | 14.95 |
3 | 20.00 | 0.15 | 15.20 |
4 | 20.00 | 1.10 | 17.10 |
Ⅲ.数据处理与讨论
(1)按实验所得数据,可折算得c(市售白醋)=________molL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是___填写序号)
a.碱式滴定管在装液前未用标准NaOH溶液润洗.
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失.
c.锥形瓶中加入待测白醋溶液后,再加少量水.
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com