
| 0.224 |
| 22.4 |
| 2.84g |
| 71g/mol |
| 0.224 |
| 22.4 |
| 2.84g |
| 71g/mol |
| 2 |
| 5 |


科目:高中化学 来源: 题型:
| A、S2-电子排布式 1s22s22p63s23p4 |
| B、在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性 |
| C、金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性 |
D、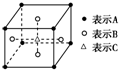 某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1:2:2. |
查看答案和解析>>
科目:高中化学 来源: 题型:
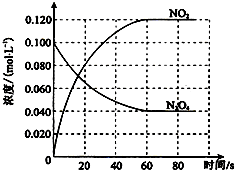 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.查看答案和解析>>
科目:高中化学 来源: 题型:


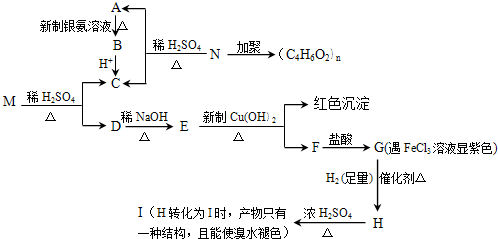
查看答案和解析>>
科目:高中化学 来源: 题型:
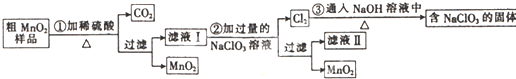
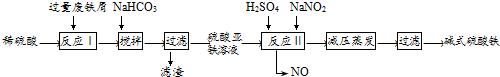
 通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )
通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )| A、CO2经催化分解为C、CO、O2的反应为放热反应 |
| B、除去Na2CO3固体中少量NaHCO3可用热分解的方法 |
| C、过氧化尿素和SO2都能使品红溶液褪色,其原理相同 |
| D、由CO2和H2合成甲醇,原子利用率达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
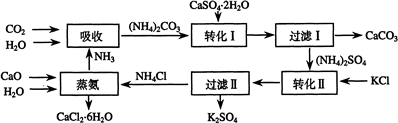
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
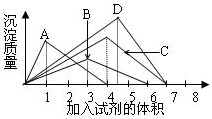 如图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应曲线变化关系的实验项( )
如图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应曲线变化关系的实验项( )| A、硝酸银溶液中加入氨水溶液 |
| B、往澄清石灰水中逐渐通入CO2气体 |
| C、往AlCl3溶液中逐NaOH溶液 |
| D、往NaAlO2溶液中逐滴加入盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
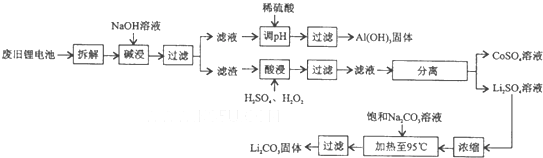
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com