
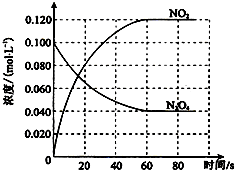
 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.| △c |
| △t |
| 0.060mol/L |
| 60S |
| c2(NO2) |
| c(N2O4) |
| (0.120mol/L)2 |
| 0.040mol/L |
| (0.16mol/L)2 |
| 0.020mol/L |


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
| A、能溶于水,氧化性 |
| B、不能溶于水,氧化性 |
| C、能溶于水,还原性 |
| D、不能溶于水,还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醛 | B、乙醛 | C、甲酸 | D、甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
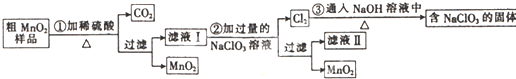
查看答案和解析>>
科目:高中化学 来源: 题型:
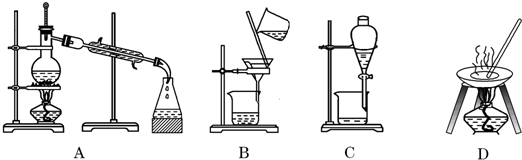
| 熔点 | 沸点 | |
| 碘 | 113.7℃ | 184.3℃ |
| 四氯化碳 | -22.6℃ | 76.8℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com