
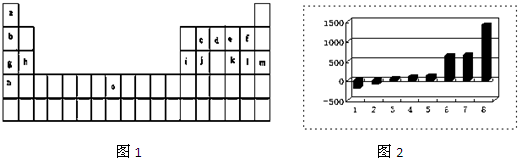
 ,HF为弱酸,弱酸电离用可逆号,即HF?H++F-,O与F相邻,依据其气态氢化物稳定性强弱可判断非金属性强弱,故a正确;F无含氧酸,故b错误;O、F都不能与酸反应,故c错误,故选a,故答案为:
,HF为弱酸,弱酸电离用可逆号,即HF?H++F-,O与F相邻,依据其气态氢化物稳定性强弱可判断非金属性强弱,故a正确;F无含氧酸,故b错误;O、F都不能与酸反应,故c错误,故选a,故答案为: ;HF?H++F-;a;
;HF?H++F-;a;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则NaOH和CH3COOH反应的中和热△H=-57.3kJ/mol |
| B、需要加热才能发生的反应一定是吸热反应 |
| C、CO(g)的燃烧热是-283.0kJ/mol,则2CO(g)+O2(g)=2CO2(g)反应的△H=-2×283.0kJ/mol |
| D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
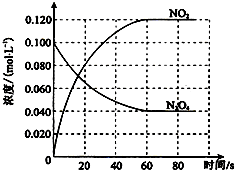 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.查看答案和解析>>
科目:高中化学 来源: 题型:
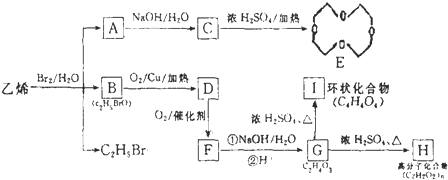
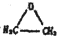 的结构可简写为
的结构可简写为 ,则E的化学式是
,则E的化学式是查看答案和解析>>
科目:高中化学 来源: 题型:


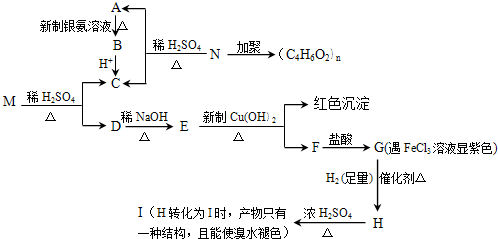
查看答案和解析>>
科目:高中化学 来源: 题型:
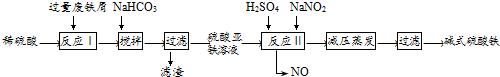
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
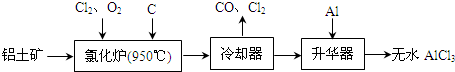
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com