
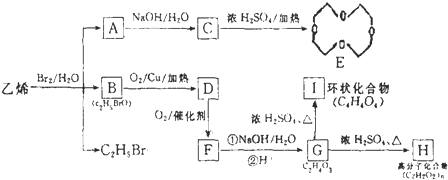
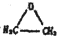 的结构可简写为
的结构可简写为 ,则E的化学式是
,则E的化学式是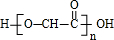 ,由G与I的分子式可知,2分子G发生酯化反应脱去2分子水生成成环状化合物I,则I为
,由G与I的分子式可知,2分子G发生酯化反应脱去2分子水生成成环状化合物I,则I为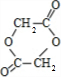 ,据此解答.
,据此解答.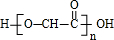 ,由G与I的分子式可知,2分子G发生酯化反应脱去2分子水生成成环状化合物I,则I为
,由G与I的分子式可知,2分子G发生酯化反应脱去2分子水生成成环状化合物I,则I为 ,
, ,故答案为:BrCH2-CH2Br;
,故答案为:BrCH2-CH2Br; ;
;| 浓硫酸 |
| △ |
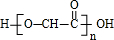 +(n-1)H2O,属于缩聚反应
+(n-1)H2O,属于缩聚反应| 浓硫酸 |
| △ |
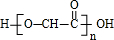 +(n-1)H2O,缩聚;
+(n-1)H2O,缩聚;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、CO2+H2O=H2CO3 |
| B、Na2O+H2O=2NaOH |
| C、2Na+2H2O=2NaOH+H2↑ |
| D、2F2+2H2O=4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、N2的电子式: | ||
B、S2-的结构示意图: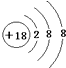 | ||
C、质子数为53、中子数为78的碘原子:
| ||
| D、16O2与18O3互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
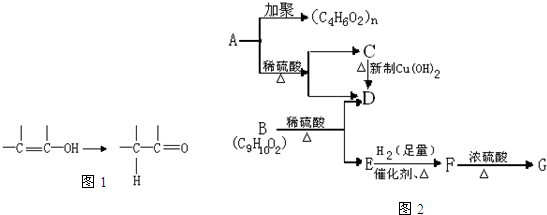
查看答案和解析>>
科目:高中化学 来源: 题型:
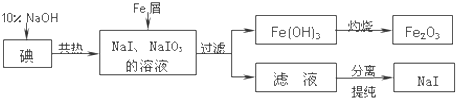
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
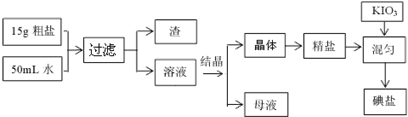
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com