
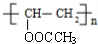 .B是芳香族化合物,在稀硫酸、加热条件下生成乙酸与E,则B属于酯类,而E能溶于NaOH溶液中,则E属于酚,结合B、D分子式可知,E分子式为C7H8O,E为甲基苯酚,E与氢气发生加成反应生成F,应是苯环发生加成反应,F含有醇羟基,F转化得到G,能使溴水褪色,应是F发生消去反应,且产物只有一种结构,则E分子中甲基与羟基处于对位,故E为
.B是芳香族化合物,在稀硫酸、加热条件下生成乙酸与E,则B属于酯类,而E能溶于NaOH溶液中,则E属于酚,结合B、D分子式可知,E分子式为C7H8O,E为甲基苯酚,E与氢气发生加成反应生成F,应是苯环发生加成反应,F含有醇羟基,F转化得到G,能使溴水褪色,应是F发生消去反应,且产物只有一种结构,则E分子中甲基与羟基处于对位,故E为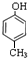 ,F为
,F为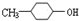 ,G为
,G为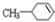 ,则B为,据此解答.
,则B为,据此解答.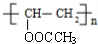 .B是芳香族化合物,在稀硫酸、加热条件下生成乙酸与E,则B属于酯类,而E能溶于NaOH溶液中,则E属于酚,结合B、D分子式可知,E分子式为C7H8O,E为甲基苯酚,E与氢气发生加成反应生成F,应是苯环发生加成反应,F含有醇羟基,F转化得到G,能使溴水褪色,应是F发生消去反应,且产物只有一种结构,则E分子中甲基与羟基处于对位,故E为
.B是芳香族化合物,在稀硫酸、加热条件下生成乙酸与E,则B属于酯类,而E能溶于NaOH溶液中,则E属于酚,结合B、D分子式可知,E分子式为C7H8O,E为甲基苯酚,E与氢气发生加成反应生成F,应是苯环发生加成反应,F含有醇羟基,F转化得到G,能使溴水褪色,应是F发生消去反应,且产物只有一种结构,则E分子中甲基与羟基处于对位,故E为 ,F为
,F为 ,G为
,G为 ,
, ,
, ;
;| △ |
 ,
,| △ |
 .
.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
| A、K+、MnO4-、Cl-、SO42- |
| B、Na+、CO32-、Cl-、SO42- |
| C、NO3-、Na+、HCO3-、Ba2+ |
| D、Na+、NO3-、NH4+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外L层上s亚层的电子总数为p亚层上的电子总数的一半 |
| Y | 元素的原子半径在短周期中最大(除稀有气体外) |
| Z | 原子核外p亚层上的电子总数比s亚层上的电子总数多2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
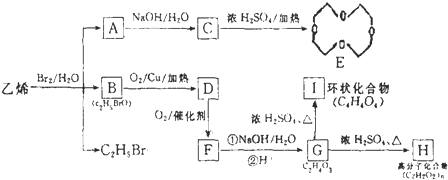
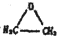 的结构可简写为
的结构可简写为 ,则E的化学式是
,则E的化学式是查看答案和解析>>
科目:高中化学 来源: 题型:
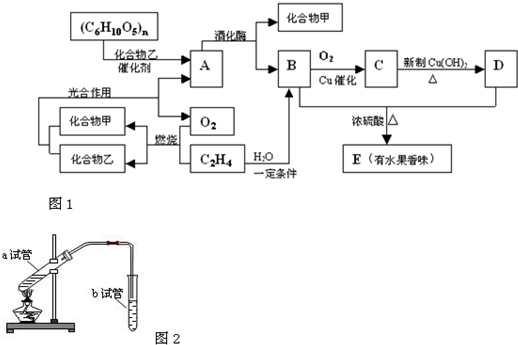
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液、NaHCO3溶液加热蒸干后均得不到原溶质 | ||
| B、稀释醋酸溶液,溶液中所有离子的浓度均降 | ||
C、0.1mol/L的醋酸溶液加水稀释后,溶液中的
| ||
| D、0.1 mol?L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
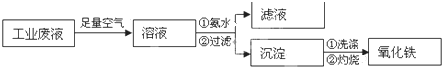
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com