
| A、能溶于水,氧化性 |
| B、不能溶于水,氧化性 |
| C、能溶于水,还原性 |
| D、不能溶于水,还原性 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、新制的氯水中只含有Cl2和H2O分子 |
| B、新制的氯水可使蓝色石蕊试纸先变蓝后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后,pH值变小,漂白能力变弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+>Cu2+>Fe3+ |
| B、Fe3+>Fe2+>Cu2+ |
| C、Fe3+>Cu2+>Fe2+ |
| D、Cu2+>Fe2+>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S2-电子排布式 1s22s22p63s23p4 |
| B、在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性 |
| C、金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性 |
D、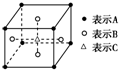 某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1:2:2. |
查看答案和解析>>
科目:高中化学 来源: 题型:
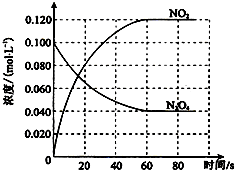 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com