(1)研究CO、SO
2、NO等大气污染气体的综合处理与利用具有重要意义.以CO或CO
2与H
2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)
.
(2)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活.
已知:①2CH
4(g)+3O
2(g)=2CO(g)+4H
2O(l)△H=-1214kJ/mol
②2CO(g)+O
2(g)=2CO
2(g)△H=-566kJ/mol
则表示甲烷燃烧热的热化学方程式
.
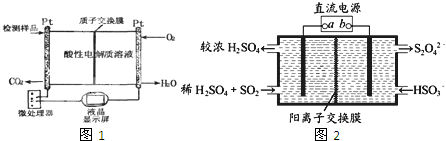
(3)如图1所示是用于合成甲醇产品中甲醇含量的检测仪.写出该仪器工作时的电极反应式:负极反应式:
(4)利用如图2所示装置(电极均为惰性电极)可吸收SO
2,并用阴极排出的溶液吸收NO
2.下列说法正确的是
阴极的电极反应式为:
(5)工业常用Na
2CO
3饱和溶液回收NO、NO
2气体:NO+NO
2+Na
2CO
3=2NaNO
2+CO
2 2NO
2+Na
2CO
3=NaNO
3+NaNO
2+CO
2若用足量的Na
2CO
3溶液完全吸收NO、NO
2混合气体,每产生标准状况下CO
2 2.24L(CO
2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO
2体积比为
.




 熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO-52e-═34CO2+10H2O.
熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO-52e-═34CO2+10H2O.