
 熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO-52e-═34CO2+10H2O.
熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO-52e-═34CO2+10H2O.
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、36L | B、22.4L |
| C、28L | D、11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、HCO3-、Cl-、Na+ |
| B、SO42-、NO3-、Ba2+、Cu2+ |
| C、MnO4-、Na+、K+、Mg2+ |
| D、Ca2+、Cl-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
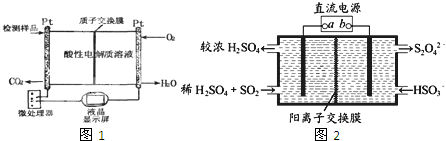
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+>Cu2+>Fe3+ |
| B、Fe3+>Fe2+>Cu2+ |
| C、Fe3+>Cu2+>Fe2+ |
| D、Cu2+>Fe2+>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
| B、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| C、根据是否有丁达尔效应将分散系分为溶液、胶体和浊液 |
| D、使用静电除尘器除去空气中的飘尘利用了胶体的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com