
| A、K+、Al3+、SO42-、OH- |
| B、Na+、Cu2+、Cl-、SO42- |
| C、SO42-、H+、Cl-、Na+ |
| D、K+、Mg2+、CO32-、NO3- |


科目:高中化学 来源: 题型:
| A、3.5 mo1 |
| B、2.5 mo1 |
| C、3 mo1 |
| D、2 mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硝酸不与氯化钠反应 |
| B、用HNO2溶液做导电试验,灯光较暗 |
| C、HNO2不稳定 |
| D、常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3和HCl |
| B、AlCl3和NaOH |
| C、NaAlO2和H2SO4 |
| D、Ba(HCO3)2和Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
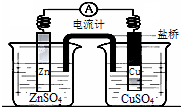
| A、铜是阳极,铜片上有气泡产生 |
| B、盐桥中的阳离子会移向CuSO4溶液 |
| C、正极附近的SO42-离子浓度逐渐增大 |
| D、锌离子在锌片表面被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
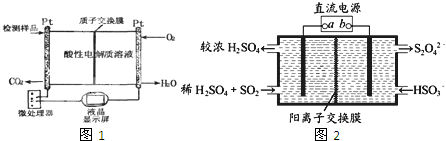
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则NaOH和CH3COOH反应的中和热△H=-57.3kJ/mol |
| B、需要加热才能发生的反应一定是吸热反应 |
| C、CO(g)的燃烧热是-283.0kJ/mol,则2CO(g)+O2(g)=2CO2(g)反应的△H=-2×283.0kJ/mol |
| D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com