
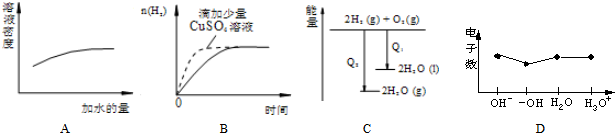
| A、浓硫酸的稀释 |
| B、过量的盐酸与等量的锌粉反应 |
| C、氢气与氧气反应中的能量变化 |
| D、微粒电子数 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S2-电子排布式 1s22s22p63s23p4 |
| B、在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性 |
| C、金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性 |
D、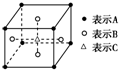 某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1:2:2. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③④ | C、②③ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则NaOH和CH3COOH反应的中和热△H=-57.3kJ/mol |
| B、需要加热才能发生的反应一定是吸热反应 |
| C、CO(g)的燃烧热是-283.0kJ/mol,则2CO(g)+O2(g)=2CO2(g)反应的△H=-2×283.0kJ/mol |
| D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
| B、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| C、根据是否有丁达尔效应将分散系分为溶液、胶体和浊液 |
| D、使用静电除尘器除去空气中的飘尘利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
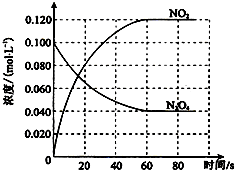 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com