
某课外小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):

(1)写出用惰性电极电解M溶液的离子方程式 。
(2)写出F的电子式 。
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是 。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是 。
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 。若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为 。

(1)2Cl-+2H2O 2OH-+H2↑+Cl2↑ (2)
2OH-+H2↑+Cl2↑ (2)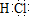 (3)水玻璃(4)溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。(5)4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓ (分步写且全正确给分)(6)3Cl2+8NH3=N2+6NH4Cl(7)c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3
(3)水玻璃(4)溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。(5)4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓ (分步写且全正确给分)(6)3Cl2+8NH3=N2+6NH4Cl(7)c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3
【解析】
试题分析:有生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰,可知,M为NaCl,C为H2,D为Cl2。B为NaOH,F为HCl。(1)电解氯化钠溶液离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑(2)F为HCl,共价化合物,电子式为
2OH-+H2↑+Cl2↑(2)F为HCl,共价化合物,电子式为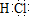 。(3)A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,与氢氧化钠的反应的产物为硅酸钠,俗称水玻璃。(4)Al能够与碱溶液发生反应,产生偏铝酸钠,当逐滴加入HCl时,产生氢氧化铝沉淀,当沉淀达到最大值是,继续滴加盐酸,沉淀溶解生成氯化铝,故能看到的实验现象是溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。(5)根据产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E
可知,E为氢氧化铁。A中含有亚铁离子。 4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓。(6)根据,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露可知,E为氨气,E与D反应的化学方程式是3Cl2+8NH3=N2+6NH4Cl。(7)由图象可知,在A中加入NaOH,先没有生成沉淀,则溶液中存在H+,继续加入NaOH后沉淀的质量不变,应含有NH4+,沉淀最后溶解,应为Al3+,则一定不含CO32-,一定含有SO42-。根据图像可知,c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3
。(3)A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,与氢氧化钠的反应的产物为硅酸钠,俗称水玻璃。(4)Al能够与碱溶液发生反应,产生偏铝酸钠,当逐滴加入HCl时,产生氢氧化铝沉淀,当沉淀达到最大值是,继续滴加盐酸,沉淀溶解生成氯化铝,故能看到的实验现象是溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。(5)根据产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E
可知,E为氢氧化铁。A中含有亚铁离子。 4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓。(6)根据,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露可知,E为氨气,E与D反应的化学方程式是3Cl2+8NH3=N2+6NH4Cl。(7)由图象可知,在A中加入NaOH,先没有生成沉淀,则溶液中存在H+,继续加入NaOH后沉淀的质量不变,应含有NH4+,沉淀最后溶解,应为Al3+,则一定不含CO32-,一定含有SO42-。根据图像可知,c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3
考点:无机物的推断;位置结构性质的相互关系应用 。


科目:高中化学 来源:海市奉贤区2012届高三上学期期末调研测试化学试题 题型:058
天然气在生活、生产中应用越来越广泛,如成为居民日常燃料,成为工业合成氨原料等.由天然气制取合成氨原料其主要反应为:
CH4(g)+H2O(g)→CO(g)+3H2(g)①
2CH4(g)+O2(g)→2CO(g)+4H2(g)②
CO(g)+H2O(g)→CO2(g)+H2(g)③
1.1 m3(标准状况)CH4按②式完全反应,产生H2________mol.(保留一位小数)
2.一定量的CH4、空气、水蒸气反应后得到某混合气体,各成分的质量分数分别是为O2 32%,N2 28%,CO2 22%,CH4 16%,H2 2%,此混合气体对氢气的相对密度是________(保留一位小数)
3.CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应后,得到的气体组成如下表:
列式计算该富氧空气中O2和N2的体积比V(O2)/V(N2)=________.反应中的CH4、H2O(g)和富氧空气的体积比=________.
4.某课外活动小组探究CH4和纯氧的反应,取CH4和纯氧组成的混合气体a mol通入装有9.36 g Na2O2固体的密闭容器中,用电火花不断引燃,使之高温下充分反应,恢复至常温时,容器内压强几乎为零.剩余固体成分与a的取值及CH4与O2的体积比值n之间有很多种情况,试帮助该小组同学填写如下几种情况.

查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第9期 总第165期 人教课标版 题型:058
食盐是日常生活的必需品,也是重要的化工原料.粗食盐中常含有少量的Ca2+、Mg2+、SO42-等杂质离子.某校课外学习小组想利用给出的试剂对粗食盐进行提纯,然后将得到的纯净的氯化钠配制成一定物质的量浓度的氯化钠溶液.
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、稀盐酸、75%乙醇、四氯化碳.
回答下列问题:
(1)欲除去粗食盐中的Ca2+、Mg2+、SO42-等离子,选用试剂的滴加顺序为________(只填化学式).
(2)用提纯后的NaCl固体配制500 mL 1.0 mol/L NaCl溶液.
仪器选择:
除容量瓶(规格:________)、托盘天平、药匙、量筒外,还需要的实验仪器是________.
实验步骤:
①计算;②________;③将②中的NaCl放入________中,用适量蒸馏水溶解;④转移溶液,并将洗涤液移入容量瓶;⑤定容,摇匀,贴标签.
误差分析:
①看到容量瓶的内壁有杂物,用蒸馏水洗净后直接使用,则所配溶液浓度________(填“偏高”、“偏低”或“无影响”,下同);
②为加速固体溶解,可稍微加热并不断搅拌.在溶液的温度未降至室温时,立即将其转移至容量瓶进行定容,则所配溶液浓度________;
③按规范的步骤逐一进行,加盖倒转摇匀后发现液面低于刻度线,未予理睬直接贴标签,则所配溶液浓度________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com