
【题目】如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列说法不正确的是
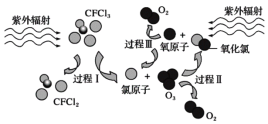
A.过程Ⅰ中断裂极性键C—Cl键
B.过程Ⅲ中O+O == O2是吸热过程
C.过程Ⅱ可表示为O3+Cl==ClO+O2
D.上述过程说明氟利昂中氯原子是破坏O3的催化剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合H+能力由大到小的顺序是______________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释醋酸,下列各式表示的数值随水量的增加而增大的是______(填字母)。
a.c(CH3COOH)/c(H+) b. c(CH3COO-)/c(CH3COOH) c. c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
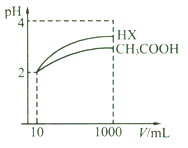
则HX的电离平衡常数________(填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)_____醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。
(6)25℃时,测得CH3COOH与CH3COONa的混合溶液pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)25℃时,pH=3的盐酸中由水电离出的c(H+)为_______。
(2)99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积Kw=_____,溶液中c(OH-)为_____。
(3)25℃时,a mol·L-1CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=________。
(4)25℃时,pH=3的醋酸和pH=11的NaOH溶液等体积混合后,溶液呈___(填“酸”、“中”或“碱”)性。
(5)25℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。该温度下将20mL 0.1mol·L-1CH3COOH溶液和20mL 0.1mol·L-1HSCN溶液分别与20mL 0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是_____________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压下,对于反应:A(g)+3B(g)![]() 3C(g),达到平衡状态的标志是( )
3C(g),达到平衡状态的标志是( )
A.v正(A)=3v逆(C)
B.密闭容器内气体的密度不再改变
C.单位时间内消耗3nmolC的同时,生成3n molB
D.密闭容器内A、B、C气体的浓度之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25 ℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 H2SO3溶液的滴定曲线如图所示。下列说法不正确的是
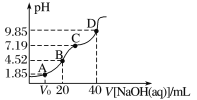
A.C点所得溶液中:c(Na+)>3c(![]() )
)
B.D点所得溶液中水解平衡常数Kh1=10- 6.81
C.A点所得溶液中:V0等于10 mL
D.B点所得溶液中:c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
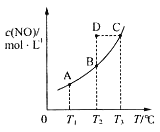
A.该反应的ΔH>0
B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2
C.在T2℃时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置(B中有导管和一个连通外界的长颈漏斗):

(1)A是氯气发生装置,其中反应的化学方程式为__________________________.
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:___________________;装置C的作用是_________________ 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___。(选填标号)
(A)有白色沉淀生成(B)无明显变化(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是__,B的作用是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是
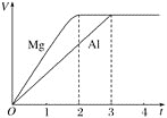
A. 二者物质的量之比为3∶2
B. 二者质量之比为3∶2
C. 二者摩尔质量之比为2∶3
D. 二者消耗H2SO4的物质的量之比为2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com