
【题目】重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO、Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
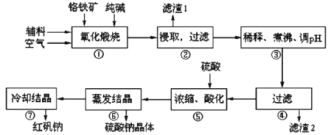
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是________。
(2)“③”中调节pH至4.7,目的是________。
(3)“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式:________。
,请写出该平衡转化的离子方程式:________。
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶(锥形瓶)中,加入10mL2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定(I2+2![]() =2I-+
=2I-+![]() )。
)。
①判断达到滴定终点的依据是:________;
②若实验中共用去Na2S2O3标准溶液40.00mL,所得产品的中Na2Cr2O7的纯度(设整个过程中其它杂质不参与反应)________。
【答案】使反应物接触更充分,加快反应速率 除去溶液中的![]() 、
、![]()
![]() 当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不恢复 0.8384(或83.84%)
当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不恢复 0.8384(或83.84%)
【解析】
铬铁矿为原料制备重铬酸钠,铬铁矿(主要成份为FeOCr2O3,还含有Al2O3、MgO、SiO2等杂质),铬铁矿经加入纯碱、空气和辅料氧化煅烧,根据题目信息可知煅烧后的固体主要成分有Na2CrO4、Fe2O3、Na2SiO3、NaAlO2以及MgO,水浸后过滤除去难溶物Fe2O3和MgO;稀释后调节pH至4.7,除去溶液中的AlO![]() 、SiO
、SiO![]() ,过滤后用硫酸酸化,再经加热浓缩、蒸发结晶得到硫酸钠晶体,再冷却结晶得到重铬酸钠。
,过滤后用硫酸酸化,再经加热浓缩、蒸发结晶得到硫酸钠晶体,再冷却结晶得到重铬酸钠。
(4)该滴定实验的原理是:先用酸化的重铬酸钠氧化碘离子生成碘单质,之后加入淀粉指示剂,淀粉遇碘变蓝,所以此时溶液呈蓝色;之后加入Na2S2O3标准溶液将碘单质还原,滴定终点碘单质被完全消耗,溶液蓝色褪去;根据消耗的Na2S2O3标准液可以计算得出被氧化生成的碘单质的量,从而确定重铬酸钠的量。
(1)固体反应物在搅拌时可充分接触而加快反应速率;
(2)根据分析可知调节pH至4.7,可使SiO![]() 、AlO
、AlO![]() 生成H2SiO3、Al(OH)3沉淀过滤除去;
生成H2SiO3、Al(OH)3沉淀过滤除去;
(3)CrO42-在酸性条件下与H+离子反应生成Cr2O72-,该反应为可逆反应,反应的离子方程式为![]() ;
;
(4)①碘单质被硫代硫酸钠还原为碘离子,碘离子不能使淀粉变蓝,据此可知滴定终点的现象应为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不恢复;
②![]() 氧化Iˉ时自身被还原成Cr3+,根据电子守恒可知6n(Na2Cr2O7·2H2O)=n(Iˉ),根据反应方程式I2+2
氧化Iˉ时自身被还原成Cr3+,根据电子守恒可知6n(Na2Cr2O7·2H2O)=n(Iˉ),根据反应方程式I2+2![]() =2I-+
=2I-+![]() 可知n(Iˉ)=n(
可知n(Iˉ)=n(![]() ),所以6n(Na2Cr2O7)= n(
),所以6n(Na2Cr2O7)= n(![]() ),则25.00mL试样溶液中n(Na2Cr2O7·2H2O)=
),则25.00mL试样溶液中n(Na2Cr2O7·2H2O)=![]() =0.0008mol,则试样中n(Na2Cr2O7)=0.0008mol×
=0.0008mol,则试样中n(Na2Cr2O7)=0.0008mol×![]() =0.008mol,所以试样中重铬酸钠的纯度为
=0.008mol,所以试样中重铬酸钠的纯度为![]() =83.84%。
=83.84%。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】以有机物A为原料合成聚合物PMA和聚碳酸酯PC的路线如下:

回答下列问题:
(1)下列关于高分子化合物的说法中正确的是________。(填标号)
a.聚乙烯分子中含有碳碳双键
b.![]() 的单体是2-丁炔
的单体是2-丁炔
c.棉花、羊毛和蚕丝是天然纤维
d.CuSO4溶液可使蛋白质变性
(2)A的化学名称是________,C中的官能团名称为_________。
(3)①的反应类型为________,③的反应类型为________。
(4)反应②的化学方程式为_____________________。
(5)B的同系物C5H8O2共有____________种同分异构体(不含立体异构),写出其中核磁共振氢谱为三组峰的物质的结构简式:______________。
(6)参照上述合成路线,以CH3CHO为原料(无机试剂任选),设计制备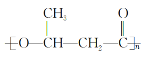 的合成路线________________。
的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
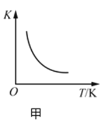
【题目】根据下列图示所得出的结论正确的是
A.图甲表示反应![]() 的平衡常数K与温度的关系,说明该反应的
的平衡常数K与温度的关系,说明该反应的![]()
B.图乙表示Cu与过量浓硝酸反应生成的![]() 气体体积随时间的变化关系,说明该反应在
气体体积随时间的变化关系,说明该反应在![]() 时间段内反应速率最快
时间段内反应速率最快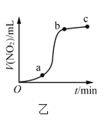
C.图丙表示一定温度下![]() 和NiS的沉淀溶解平衡曲线,说明该温度下,
和NiS的沉淀溶解平衡曲线,说明该温度下,![]() 时,两者的
时,两者的![]() 相等
相等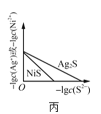
D.图丁表示相同温度下,![]() 的HF和
的HF和![]() 溶液分别加水稀释时pH的变化曲线,说明加水稀释前HF的电离程度大于
溶液分别加水稀释时pH的变化曲线,说明加水稀释前HF的电离程度大于![]() 的电离程度
的电离程度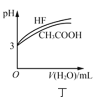
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组进行下列实验:
①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是( )
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH![]() 可能是④中沉淀溶解的原因
可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 能发生的反应类型:加成反应、取代反应、消去反应、水解反应
能发生的反应类型:加成反应、取代反应、消去反应、水解反应
B.已知![]() (X)
(X)![]()
![]() (Y),X与Y互为同分异构体,可用FeCl3溶液鉴别
(Y),X与Y互为同分异构体,可用FeCl3溶液鉴别
C.3—甲基—3—乙基戊烷的一氯代物有6种
D.相同条件下乙酸乙酯在水中的溶解度比其在乙醇中的溶解度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国亚利桑那州大学和阿贡国家实验室的科学家最近设计出生产氢气的人造树叶,原理为2H2O(g) ![]() 2H2(g)+O2(g)。有关该反应的说法错误的是( )
2H2(g)+O2(g)。有关该反应的说法错误的是( )
A.没有人造树叶和太阳能的作用该反应不能自发进行
B.该反应最终是将太阳能转化为电能
C.该反应为充分利用太阳能开辟了广阔前景
D.氢能是理想的绿色能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。已知海水提取镁的主要步骤如图:
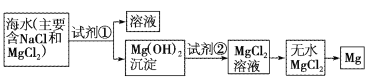
(1)关于加入试剂①作沉淀剂,有以下几种不同方法,请完成下列问题。
方法 | 是否正确 | 简述理由 |
方法1:直接往海水中加入沉淀剂 | 不正确 | 海水中镁离子浓度小,沉淀剂的用量大,不经济 |
方法2:高温加热蒸发海水后,再加入沉淀剂 | 不正确 | (一) |
你认为最合理的其他方法是:(二) | ||
(一)___;
(二)___;
(2)框图中加入的试剂①应该是___(填化学式);加入的试剂②是___(填化学式);工业上由无水MgCl2制取镁的化学方程式为___。
(3)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧示意图和相关热化学反应如下:
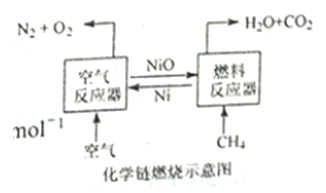
2Ni(s)+O2(g)=2NiO(s)△H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H=156.9 kJ·mol-1
下列说法错误的是( )
A. CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1
C. 甲烷在“燃料反应器”中反应时产生淡蓝色火焰并放出热量
D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
P(s)+5/4O2(g)=1/4P4O10(s) △H=-738.5kJ/mol
写出白磷转化为红磷的热化学方程式 ,由此可知,红磷比白磷 。(填“稳定”或“不稳定”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com