
【题目】常温下,向20mL0.1molL-1的HA溶液中逐滴加入0.1molL-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是( )

A.从a到d,HA的电离始终受到促进
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9molL-1
D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-)
【答案】B
【解析】
A.NaA水解促进水的电离,过量的NaOH存在抑制水的电离,从a到d,溶液中NaA不断增多,不断促进水的电离,故A正确;
B.c点存在NaA和HA,因为c点溶液为中性,pH=7,e点存在NaA和NaOH,则e点为碱性,pH>7,故B错误;
C.起始时溶液中只有HA,溶液为酸性,c水(H+)=10-11mol/L,则由HA电离出c(H+)=10-3mol/L,所以HA的电离平衡常数为Ka(HA)=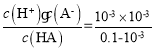 ≈10-5,所以A-的水解常数为Kh=
≈10-5,所以A-的水解常数为Kh=![]() =10-9,故C正确;
=10-9,故C正确;
D.f点加入NaOH40mL,反应产生等量的NaOH和NaA,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),存在物料守恒:c(Na+)=2c(A-)+2c(HA),则2c(HA)+c(A-)+c(H+)=c(OH-),故D正确,
故选:B。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
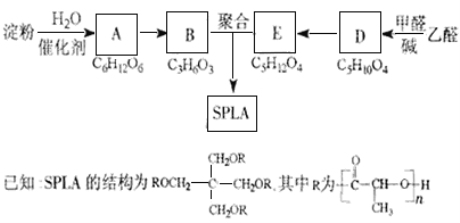
(1)淀粉是____________糖(填“单”或“多”);A的名称是_______。
(2)乙醛由不饱和烃制备的方法之一是_______________________(用化学方程式表示,可多步)。
(3)D![]() E的化学反应类型属于_________反应;D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是______;D与银氨溶液反应的化学方程式为____________________________。
E的化学反应类型属于_________反应;D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是______;D与银氨溶液反应的化学方程式为____________________________。
(4)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2反应,且1mol G与足量Na反应生成1mol H2,则G的结构简式为______。
(5)B有多种脱水产物,其中两种产物的结构简式为______和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应![]() 达到平衡时,测得
达到平衡时,测得![]() 为
为![]() 在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得
在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得![]() 为
为![]() 下列判断中不正确的是
下列判断中不正确的是
A.物质B的质量分数减小B.平衡时逆反应速率减小
C.化学计量数:![]() D.物质C的体积分数不变
D.物质C的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示得出的结论不正确的是( )
A.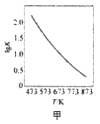 图甲是CO(g)+H2O(g)
图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
B.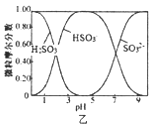 图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
C. 图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
D.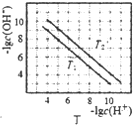 图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(C1O2)易溶于水,是一种处理水的高效安全消毒剂。实验室以NH4C1、盐酸、NaClO2为原料制备C1O2的流程如下。已知NCl3晶体在95℃就会发生爆炸性分解,在热水中易分解,在空气中易挥发。下列说法错误的是( )

A.除去C1O2中的NH3可选用饱和食盐水
B.电解时,发生反应的化学方程式为NH4C1+2HCl![]() 3H2↑+NCl3
3H2↑+NCl3
C.X溶液中大量存在的离子是Na+、C1-、H+
D.为保证实验的安全,在电解时要控制好反应温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.NaHS溶液中:K+、S2-、SO42-、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
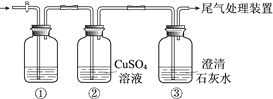
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A.③中白色浑浊是CaCO3
B.②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C.实验Ⅰ①中发生的反应是:CO2+H2O+ S2== CO32+ H2S
D.由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com