
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.NaHS溶液中:K+、S2-、SO42-、Al3+
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaC1O2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程,下列说法错误的是( )
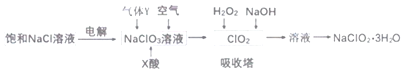
A.本工艺电解饱和氯化钠溶液时,阳极主要产生氯气,阴极产生氢气
B.吸收塔内的温度不宜过高
C.气体Y具有还原性
D.吸收塔中发生的离子反应为:H2O2+2OH-+2C1O2=2C1O2-+O2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1molL-1的HA溶液中逐滴加入0.1molL-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是( )

A.从a到d,HA的电离始终受到促进
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9molL-1
D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度均为0.1 mol/L的盐酸和醋酸溶液,下列说法正确的是( )
A. 两溶液加入等质量的锌粉,产生氢气的速率相同
B. 两溶液中氢氧根离子浓度均为![]()
C. 加入醋酸钠固体,二者的pH均增大
D. 恰好完全反应时,两溶液消耗等浓度等体积的氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO+H2)可利用甲烷与水蒸气重整反应制得。
(1)已知:①H2(g)+![]() O2(g)=H2O(g) △H1=-242kJmol-1
O2(g)=H2O(g) △H1=-242kJmol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJmol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802.6KJmo1-1
则甲烷和水蒸气重整反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H4=____。该反应的活化能E1=240.1kJmol-1,则逆反应的活化能E2=____。
CO(g)+3H2(g)△H4=____。该反应的活化能E1=240.1kJmol-1,则逆反应的活化能E2=____。
(2)重整反应中CH4的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图1所示。
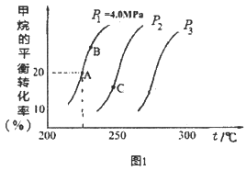
①图中A点的平衡常数KP=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),比较A、B、C三点的平衡常数Kp(A)、KP(B)、KP(C)由大到小的顺序为___。
②图中压强P1、P2、P3由大到小的顺序为___,理由是____。
(3)在恒容密闭容器中充入2mol的CH4和H2O(曲混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图2所示。请比较a、b两点CH4的转化率a点___b点(填“>”、“<”、“=”下同),a点c(CH4)___b点c[H2O(g)]。当x=1时,下列叙述正确的是____(填序号)。
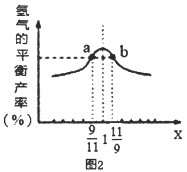
A.平衡常数K最大 B.CH4的转化率最大
C.氢气的产率最大 D.合成气的浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇具有亲水性和成膜性,在适宜的浓度下,能起类似人工泪液的作用,作为润滑剂预防或治疗眼部刺激症状。聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)“洗衣凝珠”是由一层薄膜包裹洗衣液制成的新型洗涤产品,该薄膜的主要化学成分是可溶于水的聚乙烯醇(简称PVA)塑料,聚乙烯醇的化学式为(C2H4O)n,试回答:聚乙烯醇属于_____(填“金属材料”、“有机合成材料”、“硅酸盐材料”、“复合材料”之一),从物质结构的角度解释聚乙烯醇具有亲水性的原因___________________________。
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。A、B、C、D四点中,v逆最大的是___,v正最大的是____。
(4)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.提高乙酸甲酯的平衡转化率
c.提高了醇解反应的活化能 d.使k正和k逆增大相同倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的生产、生活与化学息息相关,下列说法不正确的是![]()
![]()
A.将铝制品置于电解液中作为阳极,用电化学氧化的方法,可以在铝制品表面生成坚硬的氧化膜。
B.防治酸雨的措施可以对煤燃烧后形成的烟气脱硫,目前主要用石灰法。
C.压敏胶黏剂(即时贴)只需轻轻一压就能黏结牢固,其黏附力为分子间作用力。
D.人体所需六大营养物质:糖类、油脂、蛋白质、维生素、无机盐和水,其中产能最高的是糖类。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4 溶液与Na2CO3 溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
(沉淀制备)称取 12.5 g 胆矾溶于 87.4 mL 蒸馏水中,滴 4 滴稀硫酸,充分搅拌后得到 CuSO4 溶液。向其中加入适 量 Na2CO3 溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是______________________。所得硫酸铜溶液的溶质质量分数约 为______________________。
(2)用无水乙醇洗涤的目的是______________________。
(实验探究)同学们设计了如下装置,用制得的蓝绿色固体进行实验:
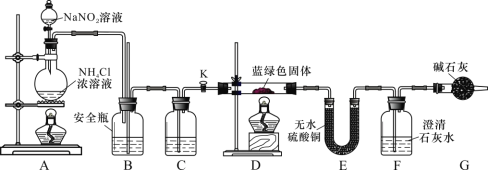
(3)D 装置加热前,需要首先打开活塞 K,用 A 装置制取适量 N2,然后关闭 K,点燃 D 处酒精灯。A 中产生N2 的作用是______________________,C 中盛装的试剂应是______________________。
(4)装置 A 中发生反应的离子方程式为______________________。
(5)若蓝绿色固体的组成为 xCuCO3·yCu(OH)2,实验能观察到的现象是_______________________________________。
(6)同学们查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用 Ba(OH)2 代替 Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是 ______________。
a.Ba(OH)2 的碱性比 Ca(OH)2 强
b.Ba(OH)2 溶解度大于 Ca(OH)2,能充分吸收 CO2;
c.相同条件下,CaCO3 的溶解度明显大于 BaCO3
d.吸收等量 CO2 生成的 BaCO3 的质量大于 CaCO3,测量误差小
待 D 中反应完全后,打开活塞 K,再次滴加 NaNO2 溶液产生 N2,其目的是 ________________________________________。若定量分析所取蓝绿色固体质量为 27.1 g,装置 F 中使用 Ba(OH)2 溶液,实验结束后, 装置 E 的质量增加 2.7 g,F 中产生沉淀 19.7 g。则该蓝绿色固体的化学式为 ____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com