
【题目】亚氯酸钠(NaC1O2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程,下列说法错误的是( )
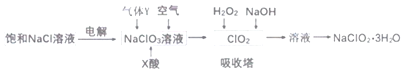
A.本工艺电解饱和氯化钠溶液时,阳极主要产生氯气,阴极产生氢气
B.吸收塔内的温度不宜过高
C.气体Y具有还原性
D.吸收塔中发生的离子反应为:H2O2+2OH-+2C1O2=2C1O2-+O2+2H2O
【答案】A
【解析】
根据流程可知,电解饱和氯化钠溶液,生成的氯气和氢氧化钠反应生成氯酸钠溶液,通气体Y、空气和X酸还原氯酸钠溶液生成二氧化氯,则气体Y具有还原性,再用双氧水、氢氧化钠吸收反应生成亚氯酸钠,过滤的亚氯酸钠(NaClO2)溶液通过蒸发浓缩冷却结晶得到亚氯酸钠晶体。
A.根据流程可知,电解饱和氯化钠溶液,阳极氯离子先失电子发生氧化反应产生氯气,氯气和阴极生成的氢氧化钠继续反应生成氯酸钠溶液,阴极氢离子得电子发生还原反应产生氢气,故A错误;
B.吸收塔内用双氧水、氢氧化钠吸收反应生成亚氯酸钠,因为温度过高,双氧水会分解,则吸收塔内的温度不宜过高,故B正确;
C.通气体Y、空气和X酸还原氯酸钠溶液生成二氧化氯,则气体Y具有还原性,故C正确;
D.吸收塔内用双氧水、氢氧化钠吸收反应生成亚氯酸钠,离子反应为:H2O2+2OH-+2C1O2=2C1O2-+O2+2H2O,故D正确;
综上所述,答案为A。


科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【制取NaNO2】
设计的制取装置如下图(夹持装置略去):

该小组先查阅资料知:①2NO+Na2O2 =2NaNO2;2NO2+Na2O2 =2NaNO3;
②NO能被酸性高锰酸钾氧化为NO3-,
(1)装置A中用于盛放稀硝酸的仪器名称为_______________,装置A中发生主要反应的离子方程式为_____________________________。
(2)装置D的作用是_____________________________。
(3)若无装置B,则进入装置D中的气体除N2、NO外还可能有_____________________________。
(4)甲同学检查装置气密性后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列可以提高NaNO2纯度的方案是____________(填字母)。
a.将B中的药品换为碱石灰 b.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 d.在装置A、B之间增加盛有水的洗气瓶
【测定制得样品中NaNO2的含量】
(5)该实验中需配制KMnO4标准溶液并酸化,应选择_______(填化学式)来酸化KMnO4溶液。
(6)已知:在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定样品中亚硝酸钠的含量,该小组称取4.0 g样品溶于水配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.100 mol·L-1的酸性KMnO4 溶液进行滴定,消耗20.00 mL酸性KMnO4溶液。滴定过程中酸性KMnO4溶液的作用是_______________,所得样品中NaNO2的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
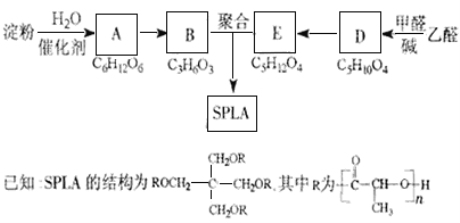
(1)淀粉是____________糖(填“单”或“多”);A的名称是_______。
(2)乙醛由不饱和烃制备的方法之一是_______________________(用化学方程式表示,可多步)。
(3)D![]() E的化学反应类型属于_________反应;D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是______;D与银氨溶液反应的化学方程式为____________________________。
E的化学反应类型属于_________反应;D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是______;D与银氨溶液反应的化学方程式为____________________________。
(4)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2反应,且1mol G与足量Na反应生成1mol H2,则G的结构简式为______。
(5)B有多种脱水产物,其中两种产物的结构简式为______和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质碳酸钙(CaCO3)是一种重要的化工产品,广泛应用于油漆、塑料、橡胶和造纸等工业。一种以低品位石灰石(含CaCO3、MnCO3、Fe2O3及A12O3)为原料生产高纯度轻质碳酸钙的循环工艺流程如图:

回答下列问题:
(1)气体A为:______,滤渣的主要成分是______。
(2)“沉钙”过程中发生的化学反应方程式为______。
(3)在NH4C1尾液中加入氧化镁并加热,发生反应的离子方程式为______。
(4)“系列操作”包含有:______。
(5)氧化镁可以在尾液处理中循环使用,______和_______可循环使用于石灰石制备轻质碳酸钙的过程中。
(6)轻质碳酸钙的工业生产还可以使用“石灰碳化法”:用高品位石灰石焙烧制得生石灰,生石灰消化制得氢氧化钙,再通入二氧化碳制得碳酸钙;本题工艺流程与“石灰碳化法,相比,优点是:______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中的原料气制取与净化是重要的环节。
(1)已知有关反应的能量变化如图1:写出![]() 与
与![]() 反应制取
反应制取![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
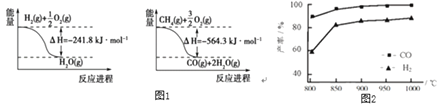
(2)“![]() 催化重整法”制氢气:
催化重整法”制氢气:![]() ,
,![]() 不仅可以得到合成气
不仅可以得到合成气![]() 和
和![]() ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
①根据键能计算,该反应的![]() ______
______![]() 。
。
化学键 | C-H | C=O | H-H |
|
键能kJ/mol | 413 | 745 | 436 | 1075 |
②按一定体积比加入![]() 和
和![]() ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和![]() 产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
③某温度下,将![]() 、
、![]() 以及催化剂进行加入
以及催化剂进行加入![]() 容器中,达到平衡时
容器中,达到平衡时![]() ,平衡常数
,平衡常数![]() ______
______![]() 。
。
(3)合成气在进入合成塔前常用醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是:![]() ,必须除去原料气中CO的原因是______。醋酸二氨合铜
,必须除去原料气中CO的原因是______。醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 吸收CO的生产适宜条件应是______
吸收CO的生产适宜条件应是______![]() 填序号
填序号![]() 。
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应![]() 达到平衡时,测得
达到平衡时,测得![]() 为
为![]() 在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得
在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得![]() 为
为![]() 下列判断中不正确的是
下列判断中不正确的是
A.物质B的质量分数减小B.平衡时逆反应速率减小
C.化学计量数:![]() D.物质C的体积分数不变
D.物质C的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.NaHS溶液中:K+、S2-、SO42-、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com