
【题目】合成氨工业中的原料气制取与净化是重要的环节。
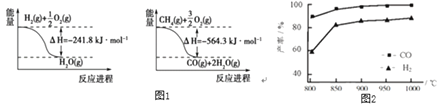
(1)已知有关反应的能量变化如图1:写出![]() 与
与![]() 反应制取
反应制取![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
(2)“![]() 催化重整法”制氢气:
催化重整法”制氢气:![]() ,
,![]() 不仅可以得到合成气
不仅可以得到合成气![]() 和
和![]() ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
①根据键能计算,该反应的![]() ______
______![]() 。
。
化学键 | C-H | C=O | H-H |
|
键能kJ/mol | 413 | 745 | 436 | 1075 |
②按一定体积比加入![]() 和
和![]() ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和![]() 产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
③某温度下,将![]() 、
、![]() 以及催化剂进行加入
以及催化剂进行加入![]() 容器中,达到平衡时
容器中,达到平衡时![]() ,平衡常数
,平衡常数![]() ______
______![]() 。
。
(3)合成气在进入合成塔前常用醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是:![]() ,必须除去原料气中CO的原因是______。醋酸二氨合铜
,必须除去原料气中CO的原因是______。醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 吸收CO的生产适宜条件应是______
吸收CO的生产适宜条件应是______![]() 填序号
填序号![]() 。
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
【答案】![]() ,
,![]()
![]()
![]() 时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低
时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低 ![]() 防止催化剂中毒 C
防止催化剂中毒 C
【解析】
(1)根据图1所示两幅能量图写出两个热化学方程式,根据盖斯定律计算所求反应的焓变;
(2)①焓变等于断裂化学键吸收的能量减去成键释放的能量;
②根据图示,温度越大,产率越大,但消耗能量高;
③K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算;
(3)根据外界条件对平衡移动的影响分析。
(1)①![]() ,
,
②![]() ,
,
根据盖斯定律②-3![]() ①得
①得![]() ,
,![]() ;
;
(2)①该反应的![]() 断裂化学键吸收能量
断裂化学键吸收能量![]() 形成化学键放出能量
形成化学键放出能量![]() ;
;
②从图象中可看出,900℃时,CO、![]() 的产率已经很高,若继续升高温度,产率增幅不大,但能耗升高,经济效益降低,所以实际生产中此反应优选温度为900℃;
的产率已经很高,若继续升高温度,产率增幅不大,但能耗升高,经济效益降低,所以实际生产中此反应优选温度为900℃;
③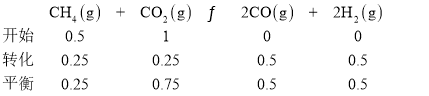
所以其平衡常数为:![]() ;
;
(3)由于CO易使催化剂中毒,所以必须除去原料气中CO;该反应是气体体积缩小的放热反应,低温高压促进反应向正反应方向进行,故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定条件下的恒温恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
A. c1:c2=1:2 B. 平衡时,Y和Z的生成速率之比为2:3
C. 若反应正向进行,X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于取代反应的是
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.nCH2=CH2![]()
![]()
C.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,氢氟酸电离常数Ka=6.8×10-4mol·L-1,醋酸电离常数Ka=1.8×10-5mol·L-1。如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系。则Y可以表示( )

A.溶液的pHB.水解平衡常数
C.水解百分率D.溶液中阴离子浓度之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaC1O2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程,下列说法错误的是( )
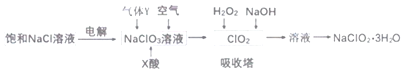
A.本工艺电解饱和氯化钠溶液时,阳极主要产生氯气,阴极产生氢气
B.吸收塔内的温度不宜过高
C.气体Y具有还原性
D.吸收塔中发生的离子反应为:H2O2+2OH-+2C1O2=2C1O2-+O2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品,在生产和科研中应用广泛,氢气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:
途径一、用水和天然气作原料一步反应制得
途径二,用煤和水作原料经多步反应制得
请回答下列问题:
(1)途径一反应的还原产物是______。
(2)途径二中的一步反应为:![]()
①上述反应达到平衡后,为提高CO的转化率,下列措施中正确的是______![]() 填写序号
填写序号![]() 。
。
A.增大压强 ![]() 降低温度
降低温度 ![]() 增大
增大![]() 的浓度
的浓度 ![]() 使用催化剂
使用催化剂
②已知1000K时,上述反应的平衡常数![]() ,若要使CO的转化率超过
,若要使CO的转化率超过![]() ,则起始时
,则起始时![]() :
:![]() 不低于______。
不低于______。
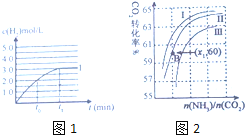
③在容积为2L的容器中发生上述反应,测得![]() 与反应时间t的变化曲线Ⅰ如图1所示,若在
与反应时间t的变化曲线Ⅰ如图1所示,若在![]() 时刻将容器的体积扩大至4L,请在答题卡图中绘出
时刻将容器的体积扩大至4L,请在答题卡图中绘出![]() 与反应时间变化的曲线Ⅱ。____________
与反应时间变化的曲线Ⅱ。____________
(3)目前常用氨气处理硝酸生产的工业尾气,在![]() 左右且有催化剂存在的情况下,氨气能把
左右且有催化剂存在的情况下,氨气能把![]() 还原成无色无毒气体,直接排入空气中,已知氢气的燃烧热为
还原成无色无毒气体,直接排入空气中,已知氢气的燃烧热为![]() ,
,![]() ,
,![]() 。试写出氨气与
。试写出氨气与![]() 反应生成无毒气体和液态水的热化学方程式______。
反应生成无毒气体和液态水的热化学方程式______。
(4)工业上用氨和二氧化碳反应合成尿素,其反应为:CO2+2NH3=CO(NH2)2+H2O;![]() 生成过程中,原料气常混有水蒸气,
生成过程中,原料气常混有水蒸气,![]() 的转化率与氨碳比
的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系如图2所示:
的变化关系如图2所示:
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最小的是______。
②若B点氨的转化率为![]() ,则
,则![]() ______。
______。
(5)某同学将![]() 和
和![]() 按物质的量之比2:1通入水中,充分反应所得溶液中
按物质的量之比2:1通入水中,充分反应所得溶液中![]() 、
、![]() 、
、![]() 三种离子浓度由大到小的顺序是______
三种离子浓度由大到小的顺序是______![]() 已知:氨水、碳酸的电离平衡常数如表
已知:氨水、碳酸的电离平衡常数如表![]()
弱电解质 | 化学式 | 电离常数 |
氨水 |
|
|
碳酸 |
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是

A. a、b、c三个状态只有b是平衡状态
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2<T1,则正反应一定是吸热反应
D. b点时,平衡体系中A、B原子数之比接近1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇具有亲水性和成膜性,在适宜的浓度下,能起类似人工泪液的作用,作为润滑剂预防或治疗眼部刺激症状。聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)“洗衣凝珠”是由一层薄膜包裹洗衣液制成的新型洗涤产品,该薄膜的主要化学成分是可溶于水的聚乙烯醇(简称PVA)塑料,聚乙烯醇的化学式为(C2H4O)n,试回答:聚乙烯醇属于_____(填“金属材料”、“有机合成材料”、“硅酸盐材料”、“复合材料”之一),从物质结构的角度解释聚乙烯醇具有亲水性的原因___________________________。
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。A、B、C、D四点中,v逆最大的是___,v正最大的是____。
(4)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.提高乙酸甲酯的平衡转化率
c.提高了醇解反应的活化能 d.使k正和k逆增大相同倍数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com